题目
y习题 ^circ gt (20)^circ C 时,纯苯及纯甲苯的蒸气压分别为 .92times (10)^3Pa 和 .93times (10)^3Pa 若混-|||-合等质量的苯和甲苯形成理想液态混合物,试求在蒸气相中;(1)苯的分压;(2)甲苯的分.-|||-压;(3)总蒸气压;(4)苯及甲苯在气相中的摩尔分数。

题目解答
答案
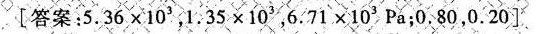
解析
步骤 1:计算苯和甲苯的摩尔分数
由于混合物是等质量的苯和甲苯,我们需要计算它们的摩尔分数。苯和甲苯的摩尔质量分别为 $78.11\,g/mol$ 和 $92.14\,g/mol$。假设混合物中苯和甲苯的质量均为 $m$,则它们的摩尔数分别为 $n_{苯} = \frac{m}{78.11}$ 和 $n_{甲苯} = \frac{m}{92.14}$。因此,苯和甲苯的摩尔分数分别为:
$$
x_{苯} = \frac{n_{苯}}{n_{苯} + n_{甲苯}} = \frac{\frac{m}{78.11}}{\frac{m}{78.11} + \frac{m}{92.14}} = \frac{92.14}{78.11 + 92.14} = 0.546
$$
$$
x_{甲苯} = \frac{n_{甲苯}}{n_{苯} + n_{甲苯}} = \frac{\frac{m}{92.14}}{\frac{m}{78.11} + \frac{m}{92.14}} = \frac{78.11}{78.11 + 92.14} = 0.454
$$
步骤 2:计算苯和甲苯的分压
根据拉乌尔定律,理想液态混合物中组分的分压等于该组分在纯态时的蒸气压乘以其在混合物中的摩尔分数。因此,苯和甲苯的分压分别为:
$$
P_{苯} = x_{苯} \times P_{苯}^{0} = 0.546 \times 9.92 \times 10^{3}Pa = 5.42 \times 10^{3}Pa
$$
$$
P_{甲苯} = x_{甲苯} \times P_{甲苯}^{0} = 0.454 \times 2.93 \times 10^{3}Pa = 1.33 \times 10^{3}Pa
$$
步骤 3:计算总蒸气压
总蒸气压等于各组分分压之和:
$$
P_{总} = P_{苯} + P_{甲苯} = 5.42 \times 10^{3}Pa + 1.33 \times 10^{3}Pa = 6.75 \times 10^{3}Pa
$$
步骤 4:计算苯和甲苯在气相中的摩尔分数
根据道尔顿分压定律,组分在气相中的摩尔分数等于其分压与总蒸气压的比值。因此,苯和甲苯在气相中的摩尔分数分别为:
$$
y_{苯} = \frac{P_{苯}}{P_{总}} = \frac{5.42 \times 10^{3}Pa}{6.75 \times 10^{3}Pa} = 0.80
$$
$$
y_{甲苯} = \frac{P_{甲苯}}{P_{总}} = \frac{1.33 \times 10^{3}Pa}{6.75 \times 10^{3}Pa} = 0.20
$$
由于混合物是等质量的苯和甲苯,我们需要计算它们的摩尔分数。苯和甲苯的摩尔质量分别为 $78.11\,g/mol$ 和 $92.14\,g/mol$。假设混合物中苯和甲苯的质量均为 $m$,则它们的摩尔数分别为 $n_{苯} = \frac{m}{78.11}$ 和 $n_{甲苯} = \frac{m}{92.14}$。因此,苯和甲苯的摩尔分数分别为:
$$
x_{苯} = \frac{n_{苯}}{n_{苯} + n_{甲苯}} = \frac{\frac{m}{78.11}}{\frac{m}{78.11} + \frac{m}{92.14}} = \frac{92.14}{78.11 + 92.14} = 0.546
$$
$$
x_{甲苯} = \frac{n_{甲苯}}{n_{苯} + n_{甲苯}} = \frac{\frac{m}{92.14}}{\frac{m}{78.11} + \frac{m}{92.14}} = \frac{78.11}{78.11 + 92.14} = 0.454
$$
步骤 2:计算苯和甲苯的分压
根据拉乌尔定律,理想液态混合物中组分的分压等于该组分在纯态时的蒸气压乘以其在混合物中的摩尔分数。因此,苯和甲苯的分压分别为:
$$
P_{苯} = x_{苯} \times P_{苯}^{0} = 0.546 \times 9.92 \times 10^{3}Pa = 5.42 \times 10^{3}Pa
$$
$$
P_{甲苯} = x_{甲苯} \times P_{甲苯}^{0} = 0.454 \times 2.93 \times 10^{3}Pa = 1.33 \times 10^{3}Pa
$$
步骤 3:计算总蒸气压
总蒸气压等于各组分分压之和:
$$
P_{总} = P_{苯} + P_{甲苯} = 5.42 \times 10^{3}Pa + 1.33 \times 10^{3}Pa = 6.75 \times 10^{3}Pa
$$
步骤 4:计算苯和甲苯在气相中的摩尔分数
根据道尔顿分压定律,组分在气相中的摩尔分数等于其分压与总蒸气压的比值。因此,苯和甲苯在气相中的摩尔分数分别为:
$$
y_{苯} = \frac{P_{苯}}{P_{总}} = \frac{5.42 \times 10^{3}Pa}{6.75 \times 10^{3}Pa} = 0.80
$$
$$
y_{甲苯} = \frac{P_{甲苯}}{P_{总}} = \frac{1.33 \times 10^{3}Pa}{6.75 \times 10^{3}Pa} = 0.20
$$