第六章化学平衡0601.某温度时,NH4Cl(s)分解压力是标准压力,则分解反应的平衡常数为:(A) 1(B) 1/2(C) 1/4(D) 1/80602.化学反应体系在等温等压下发生Δξ= 1 mol反应,所引起体系吉布斯自由能的改变值ΔrGm的数值正好等于体系化学反应吉布斯自由能(aG/aξ)T,p,的条件是:(A)体系发生单位反应(B)反应达到平衡(C)反应物处于标准状态(D)无穷大体系中所发生的单位反应0603.在恒温恒压下,化学反应a A + b B = dD +e E的ΔrGm所代表的意义在下列说法中哪种是________的?(A)ΔrGm表示有限物系中反应进行时产物与反应物间的吉氏自由能之差(即终态与始态的自由能之差)(B)ΔrGm表示有限的反应物系处于该反应进度a时的反应倾向(C)ΔrGm表示若维持各反应物化学势不变时发生一个单位反应时的吉布斯自由能变化(D)ΔrGm代表变化率,即表示在G-ξ图上反应进度为a时的曲率线斜率0604.在等温等压下,当反应的-|||-【 /x),一= 5 kJ/mol时,该反应能否进行?(A)能正向自发进行(B)能逆向自发进行(C)不能判断(D)不能进行0605.一密闭容器处于283.15 K的恒温环境中,内有水及其相平衡的水蒸气。现充入惰性气体(即气体既不与水反应,也不溶于水中),则水蒸气的压力:(A)增加(B)减少(C)不变(D)惰性气体压力低于101 325 Pa,水蒸气压增加,高于101 325 Pa时,则减小。0606.理想气体反应CO(g) + 2H2(g)=CH3OH(g)的与温度T的关系为:=-21 660+52.92T,若要使反应的平衡常数K>1,则应控制的反应温度:(A)必须低于409.3℃(B)必须高于409.3 K(C)必须低于409.3 K(D)必须等于409.3 K0607.25℃时水的饱和蒸气压为3.168 kPa,此时液态水的标准生成吉布斯自由能= - 237.19 kJ/mol,则水蒸气的标准生成吉布斯自由能为:(A) -245.76 kJ/mol(B) -229.34 kJ/mol(C) -245.04 kJ/mol(D) -228.60 kJ/mol0608.在T,p时,理想气体反应C2H6(g)=H2(g) + C2H4(g)的Kc/Kx为:(A)RT(B) 1/(RT)(C)RT/p(D)p/(RT)0609.下述说法中哪一种正确?(A)增加压力一定有利于液体变为固体(B)增加压力一定不利于液体变为固体(C)增加压力不一定有利于液体变为固体(D)增加压力与液体变为固体无关0610.反应CH3COOH(l) + C2H5OH(l) = CH3COOC2H5(l) + H2O(l)在25℃时平衡常数K为4.0,今以CH3COOH及C2H5OH各1mol混合进行反应,则达平衡最大产率为:(A) 0.334% (B) 33.4%(C) 66.7%(D) 50.0%0611.某实际气体反应在温度为500 K、压力为20260 kPa下的平衡常数Kf=2,则该反应在500 K、20.26 kPa下反应的平衡常数Kp为:(A) 2(B)>2(C)<2(D) ≥ 20612.对于理想气体间反应,以各种形式表示的平衡常数中,其值与温度和压力皆有关系的是:(A) Ka(B) Kc(C) Kp(D) Kx0613.某低压下的气相反应,在T=200 K时Kp=831.4 Pa,则Kc/(mol/cm)是:(A) 500(B) 14000000(C) 14000(D) 0.50614.在通常温度下,NH4HCO3(s)可发生下列分解反应:NH4HCO3(s)=NH3(g) + CO2(g) + H2O(g)设在两个容积相等的密闭容器A和B中,分别加入纯NH4HCO3(s)1kg及20 kg,均保持在298 K达到平衡后,下列哪种说法是正确的?(A)两容器中压力相等(B) A内压力大于B内压力(C) B内压力大于A内压力(D)须经实际测定方能判别哪个容器中压力大0615.根据某一反应的值,下列何者________:(A)标准状态下自发变化的方向(B)在所对应的温度下的平衡位置(C)在标准状态下体系所能作的最大非膨胀功(D)提高温度反应速率的变化趋势0616.在298 K时,气相反应H2+I2=2HI的标准吉布斯自由能变化值=-16 778 J/mol,则反应的平衡常数为:(A) 2.0×1012(B) 5.91×106(C) 873(D) 18.90617.某实际气体反应,用逸度表示的平衡常数Kf随下列哪些因素而变:(A)体系的总压力(B)催化剂(C)温度(D)惰性气体的量0618.对于气相反应,当体系总压力p变化时:(A)对无影响(B)对Kc无影响(C)对Kp无影响(D)对-|||-【 /x),一,Kc,Kp均无影响0619.对反应CO(g)+H2O(g)=H2(g)+CO2(g)(A)=1(B)=Kc(C)>Kc(D)<Kc0620.化学反应等温式-|||-【 /x),一,当选取不同标准态时,反应的-|||-【 /x),一将改变,该反应的-|||-【 /x),一和-|||-【 /x),一将:(A)都随之改变(B)都不改变(C)-|||-【 /x),一变,-|||-【 /x),一不变(D)-|||-【 /x),一不变,-|||-【 /x),一改变0621.已知反应2NH3= N2+ 3H2在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应(1/2) N2+(3/2) H2= NH3的标准平衡常数为:(A) 4(B) 0.5(C) 2(D) 10622.Ag2O分解可用下列两个反应方程之一表示,其相应的平衡常数也一并列出I.Ag2O(s) === 2Ag(s) + (1/2)O2(g)Kp(Ⅰ)II. 2Ag2O(s) === 4Ag(s) + O2(g)Kp(Ⅱ)设气相为理想气体,而且已知反应是吸热的,试问下列结论是正确的是:(A)(B)(C) O2的平衡压力与计量方程的写法无关(D)-|||-【 /x),一随温度降低而减小0623.某化学反应在298 K时的标准吉布斯自由能变化为负值,则该温度时反应的-|||-【 /x),一值将:(A)-|||-【 /x),一(B)(C)(D)0624.在一定温度和压力下,对于一个化学反应,能用以判断其反应方向的是:(A)(B)(C)(D)0625.对理想气体反应CO(g) + H2O(g) = H2(g) + CO2(g) ,下述关系正确的是:(A) Kx< Kp(B) Kp= Kx(C) Kx= Kc(D) Kp< Kc0626.下列平衡常数中,量纲为1的是:(A)Kf,Kp,K(B)Kx,Kp,K(C)Kc,Ka,Kx(D),Ka,Kx0627.已知分解反应NH2COONH4(s) = 2NH3(g) + CO2(g)在30℃时的平衡常数K= 0.000 655,则此时NH2COONH4(s)的分解压力为:(A) 16630 Pa(B) 594000 Pa(C) 5542 Pa(D) 2928 Pa0628.在温度为T,压力为p时,反应3O2(g)=2O3(g)的Kp与Kx的比值为(A)RT(B)p(C)1/(RT)(D)1/p0629.已知445℃时, Ag2O(s)的分解压力为20 974 kPa,则此时分解反应Ag2O(s)=2Ag(s)+(1/2)O2(g)的为:(A) 14.387 J/mol(B) 15.92 kJ/mol(C) -15.92 kJ/mol(D) -31.83 kJ/mol0630.反应2HgO(s)=2Hg(g) + O2(g)在101 325 Pa、分解温度时的分压p(Hg)等于:(A) 101.325 kPa(B) (101.325 /2) kPa(C) (101.325 /3) kPa(D) (2/3)×101.325 kPa0631.对一个理想气体化学反应的平衡常数与其标准吉布斯自由能变化的关系有:(1)-|||-【 /x),一(2)-|||-【 /x),一(3)-|||-【 /x),一其中关系正确的是:(A) (1)、(2)和(3)式均正确(B) (1)式正确(C) (2)式正确(D) (3)式正确0632.理想气体化学反应平衡时,应用下列哪个关系式?(A)(B)(C)-|||-【 /x),一(D)-|||-【 /x),一0633.在一定的温度下,一定量的PCl5(g)在一密闭容器中达到分解平衡PCl5(g)=PCl3(g) + Cl2(g)。若往容器中充入氮气,使体系的压力增加一倍(体积不变),则PCl5的解离度将:(A)增加(B)减少(C)不变(D)不定0634.在刚性密闭容器中,有下列理想气体的反应达到平衡A(g) + B(g)=C(g)若在恒温下加入一定量的惰性气体,则平衡将:(A)向右移动(B)向左移动(C)不移动(D)无法确定0635.PCl5的分解反应是PCl5(g)=PCl3(g) + Cl2(g),在473 K达到平衡时,PCl5(g)有48.5%分解,在573 K达到平衡时,有97%分解,则此反应为:(A)放热反应(B)吸热反应(C)即不放热也不吸热(D)这两个温度下的平衡常数相等
第六章化学平衡
0601.某温度时,NH4Cl(s)分解压力是标准压力,则分解反应的平衡常数为:
(A) 1(B) 1/2(C) 1/4(D) 1/8
0602.化学反应体系在等温等压下发生Δξ= 1 mol反应,所引起体系吉布斯自由能的改变值ΔrGm的数值正好等于体系化学反应吉布斯自由能(aG/aξ)T,p,的条件是:
(A)体系发生单位反应(B)反应达到平衡
(C)反应物处于标准状态(D)无穷大体系中所发生的单位反应
0603.在恒温恒压下,化学反应a A + b B = dD +e E的ΔrGm所代表的意义在下列说法中哪种是________的?
(A)ΔrGm表示有限物系中反应进行时产物与反应物间的吉氏自由能之差(即终态与始态的自由能之差)
(B)ΔrGm表示有限的反应物系处于该反应进度a时的反应倾向
(C)ΔrGm表示若维持各反应物化学势不变时发生一个单位反应时的吉布斯自由能变化
(D)ΔrGm代表变化率,即表示在G-ξ图上反应进度为a时的曲率线斜率
0604.在等温等压下,当反应的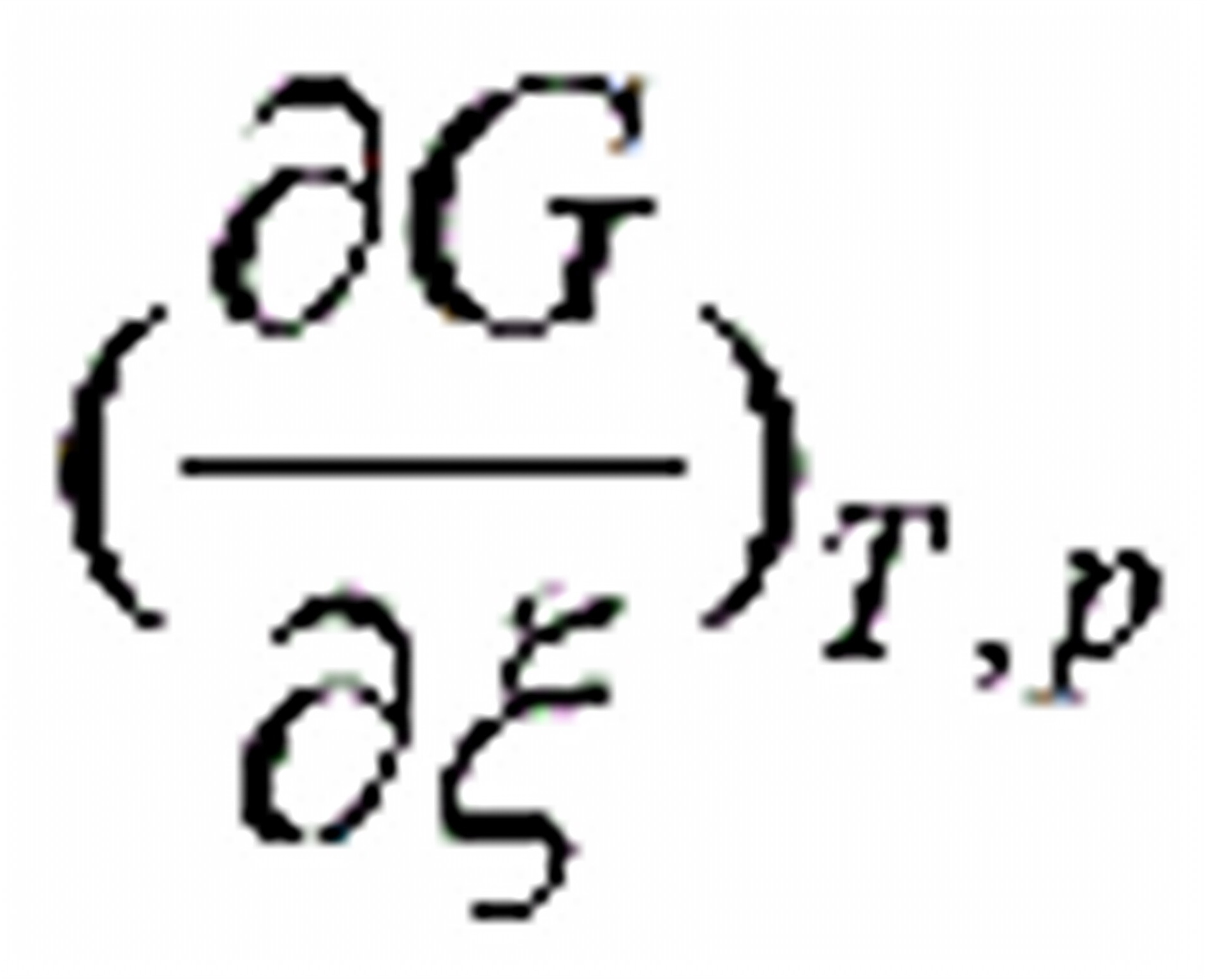 = 5 kJ/mol时,该反应能否进行?
= 5 kJ/mol时,该反应能否进行?
(A)能正向自发进行(B)能逆向自发进行(C)不能判断(D)不能进行
0605.一密闭容器处于283.15 K的恒温环境中,内有水及其相平衡的水蒸气。现充入惰性气体(即气体既不与水反应,也不溶于水中),则水蒸气的压力:
(A)增加(B)减少(C)不变
(D)惰性气体压力低于101 325 Pa,水蒸气压增加,高于101 325 Pa时,则减小。
0606.理想气体反应CO(g) + 2H2(g)=CH3OH(g)的与温度T的关系为:=-21 660+52.92T,若要使反应的平衡常数K>1,则应控制的反应温度:
(A)必须低于409.3℃(B)必须高于409.3 K
(C)必须低于409.3 K(D)必须等于409.3 K
0607.25℃时水的饱和蒸气压为3.168 kPa,此时液态水的标准生成吉布斯自由能= - 237.19 kJ/mol,则水蒸气的标准生成吉布斯自由能为:
(A) -245.76 kJ/mol(B) -229.34 kJ/mol(C) -245.04 kJ/mol(D) -228.60 kJ/mol
0608.在T,p时,理想气体反应C2H6(g)=H2(g) + C2H4(g)的Kc/Kx为:
(A)RT(B) 1/(RT)(C)RT/p(D)p/(RT)
0609.下述说法中哪一种正确?
(A)增加压力一定有利于液体变为固体
(B)增加压力一定不利于液体变为固体
(C)增加压力不一定有利于液体变为固体
(D)增加压力与液体变为固体无关
0610.反应CH3COOH(l) + C2H5OH(l) = CH3COOC2H5(l) + H2O(l)在25℃时平衡常数K为4.0,今以CH3COOH及C2H5OH各1mol混合进行反应,则达平衡最大产率为:
(A) 0.334% (B) 33.4%(C) 66.7%(D) 50.0%
0611.某实际气体反应在温度为500 K、压力为20260 kPa下的平衡常数Kf=2,则该反应在500 K、20.26 kPa下反应的平衡常数Kp为:
(A) 2(B)>2(C)<2(D) ≥ 2
0612.对于理想气体间反应,以各种形式表示的平衡常数中,其值与温度和压力皆有关系的是:
(A) Ka(B) Kc(C) Kp(D) Kx
0613.某低压下的气相反应,在T=200 K时Kp=831.4 Pa,则Kc/(mol/cm)是:
(A) 500(B) 14000000(C) 14000(D) 0.5
0614.在通常温度下,NH4HCO3(s)可发生下列分解反应:NH4HCO3(s)=NH3(g) + CO2(g) + H2O(g)设在两个容积相等的密闭容器A和B中,分别加入纯NH4HCO3(s)1kg及20 kg,均保持在298 K达到平衡后,下列哪种说法是正确的?
(A)两容器中压力相等(B) A内压力大于B内压力
(C) B内压力大于A内压力(D)须经实际测定方能判别哪个容器中压力大
0615.根据某一反应的值,下列何者________:
(A)标准状态下自发变化的方向
(B)在所对应的温度下的平衡位置
(C)在标准状态下体系所能作的最大非膨胀功
(D)提高温度反应速率的变化趋势
0616.在298 K时,气相反应H2+I2=2HI的标准吉布斯自由能变化值=-16 778 J/mol,则反应的平衡常数为:
(A) 2.0×1012(B) 5.91×106(C) 873(D) 18.9
0617.某实际气体反应,用逸度表示的平衡常数Kf随下列哪些因素而变:
(A)体系的总压力(B)催化剂(C)温度(D)惰性气体的量
0618.对于气相反应,当体系总压力p变化时:
(A)对无影响(B)对Kc无影响
(C)对Kp无影响(D)对 ,Kc,Kp均无影响
,Kc,Kp均无影响
0619.对反应CO(g)+H2O(g)=H2(g)+CO2(g)
(A)=1(B)=Kc(C)>Kc(D)<Kc
0620.化学反应等温式 ,当选取不同标准态时,反应的
,当选取不同标准态时,反应的 将改变,该反应的
将改变,该反应的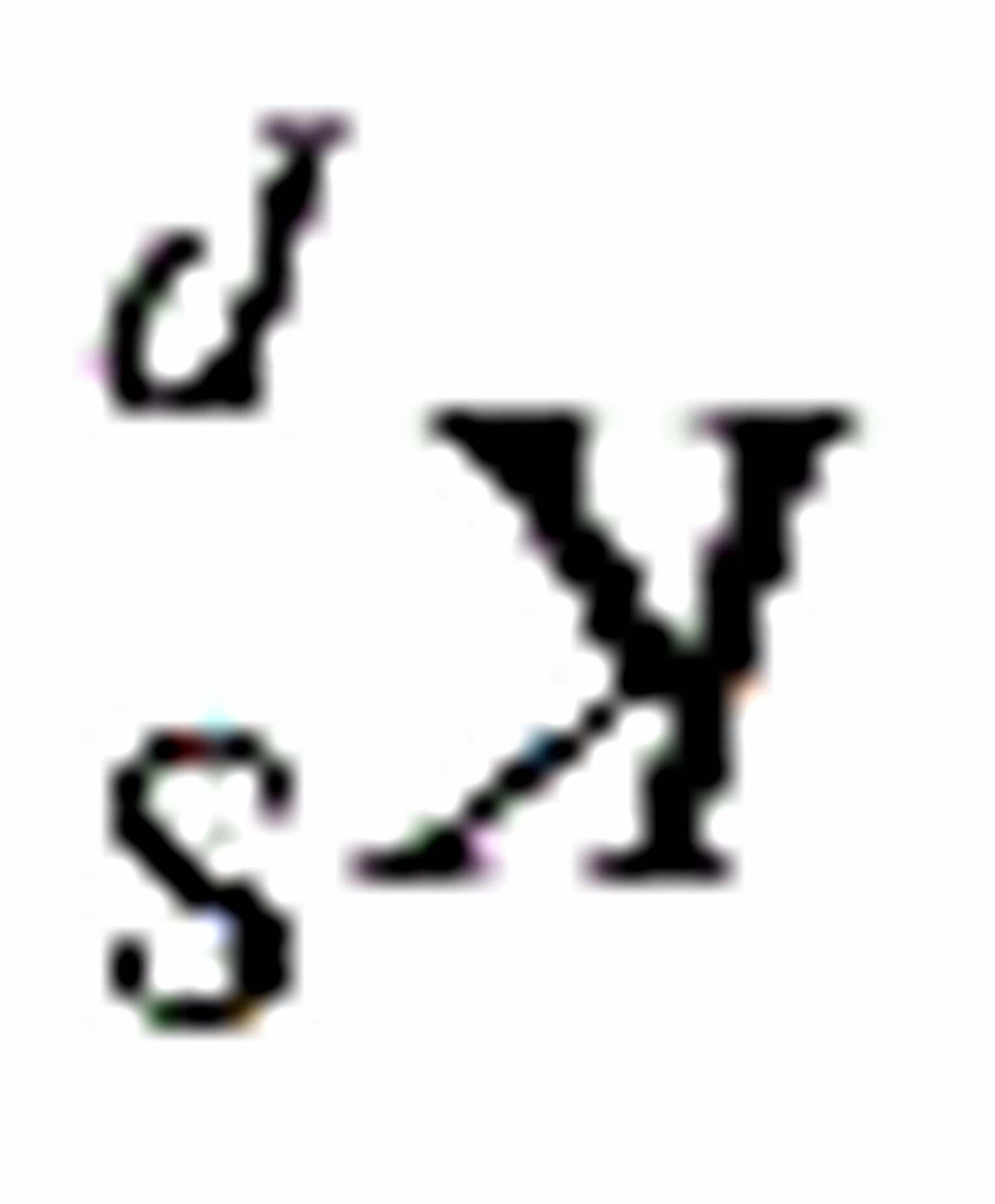 和
和 将:
将:
(A)都随之改变(B)都不改变(C)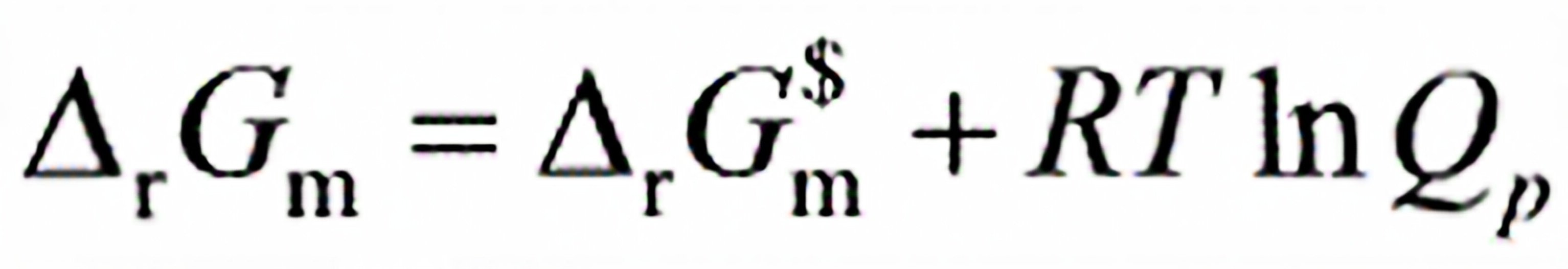 变,
变,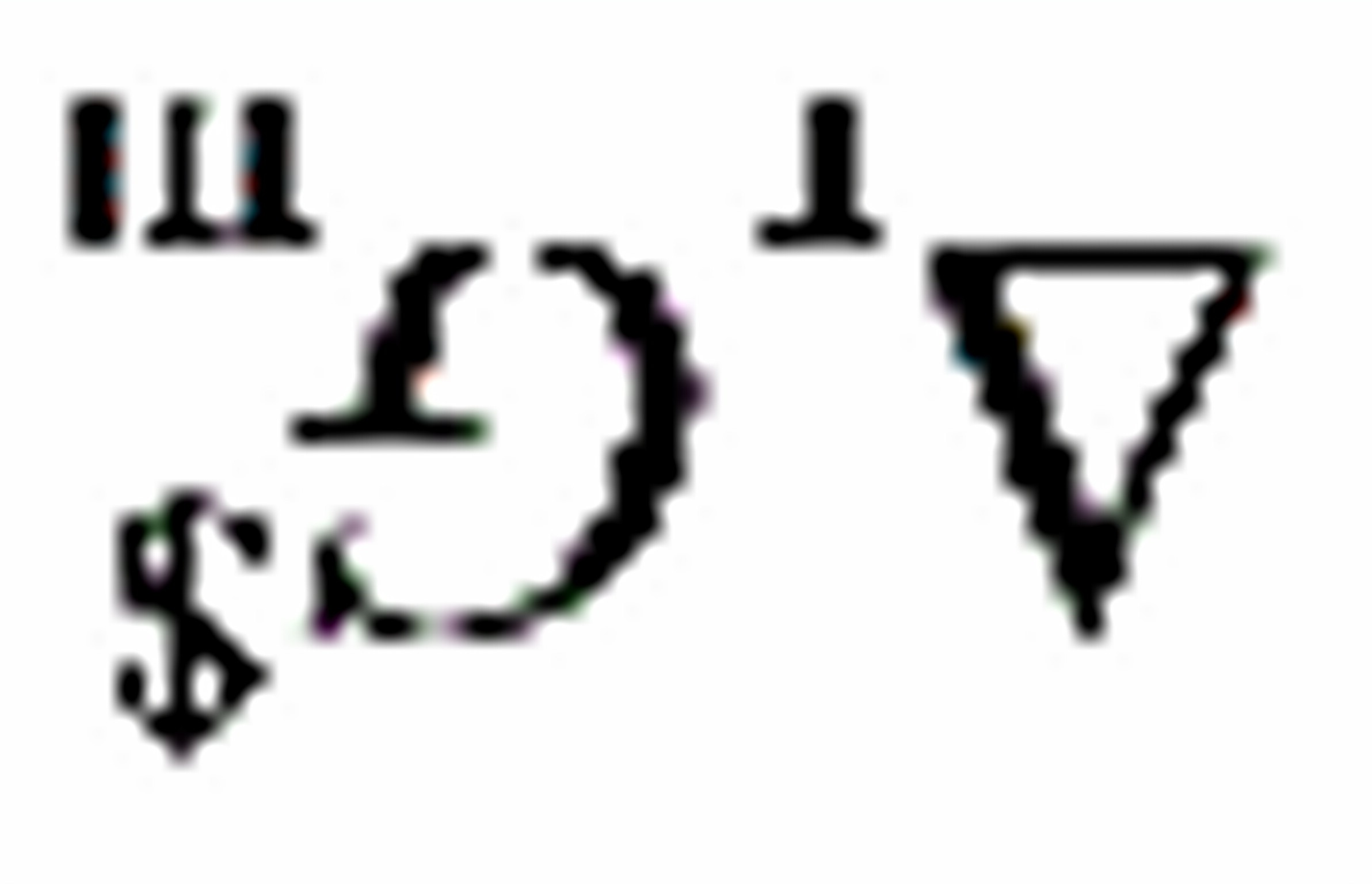 不变(D)
不变(D)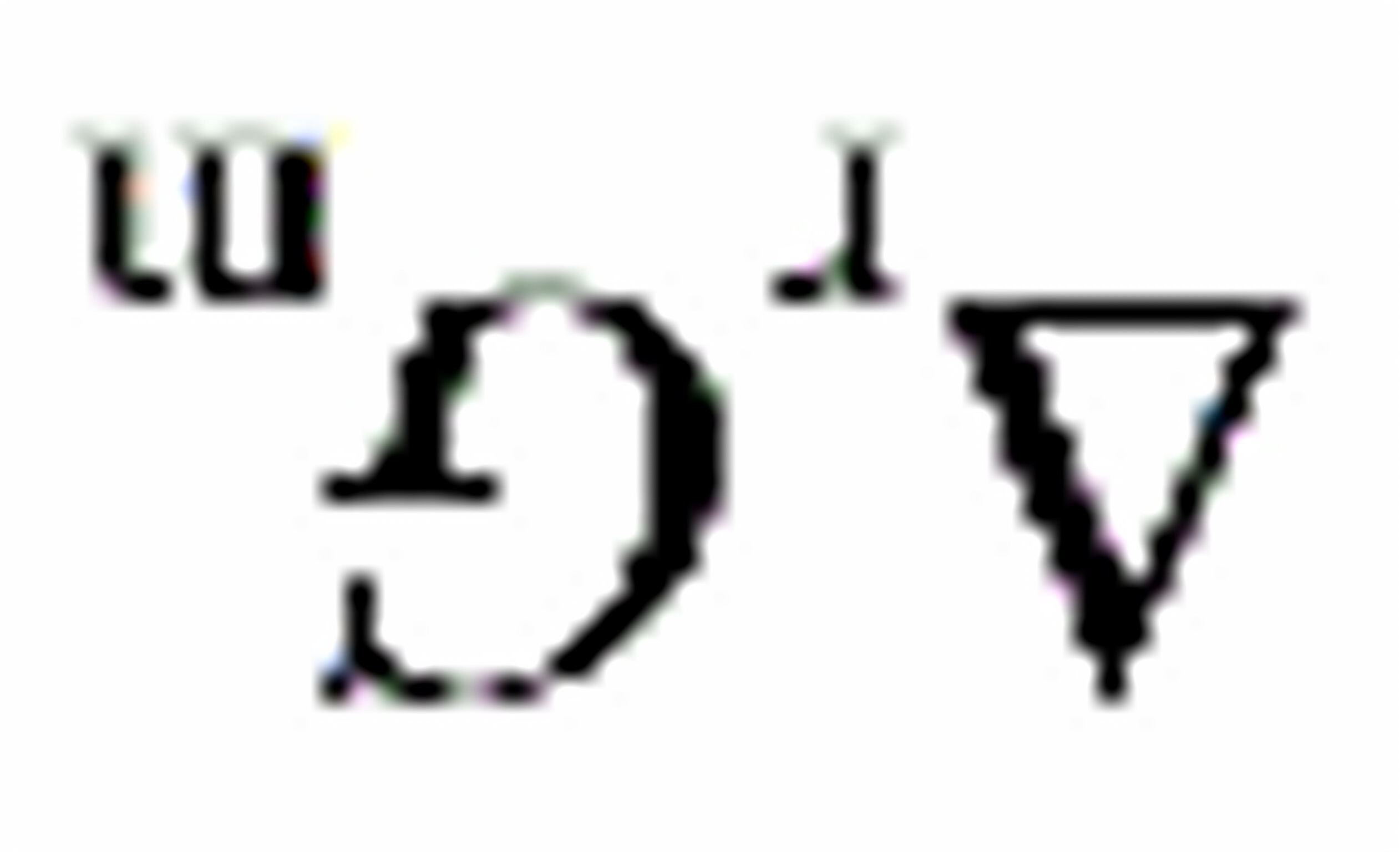 不变,
不变,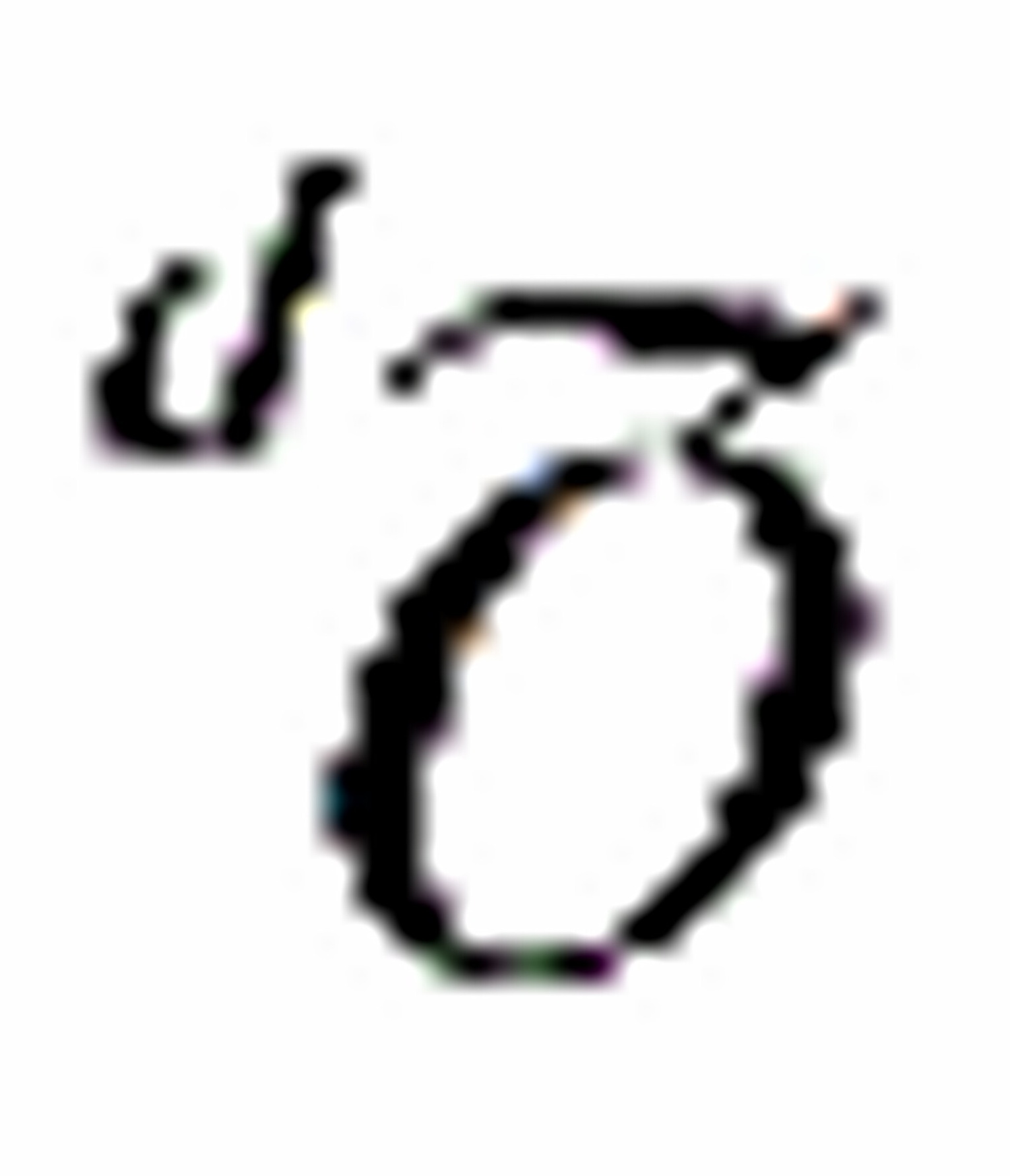 改变
改变
0621.已知反应2NH3= N2+ 3H2在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应(1/2) N2+(3/2) H2= NH3的标准平衡常数为:
(A) 4(B) 0.5(C) 2(D) 1
0622.Ag2O分解可用下列两个反应方程之一表示,其相应的平衡常数也一并列出
I.Ag2O(s) === 2Ag(s) + (1/2)O2(g)Kp(Ⅰ)
II. 2Ag2O(s) === 4Ag(s) + O2(g)Kp(Ⅱ)设气相为理想气体,而且已知反应是吸热的,试问下列结论是正确的是:
(A)(B)
(C) O2的平衡压力与计量方程的写法无关(D)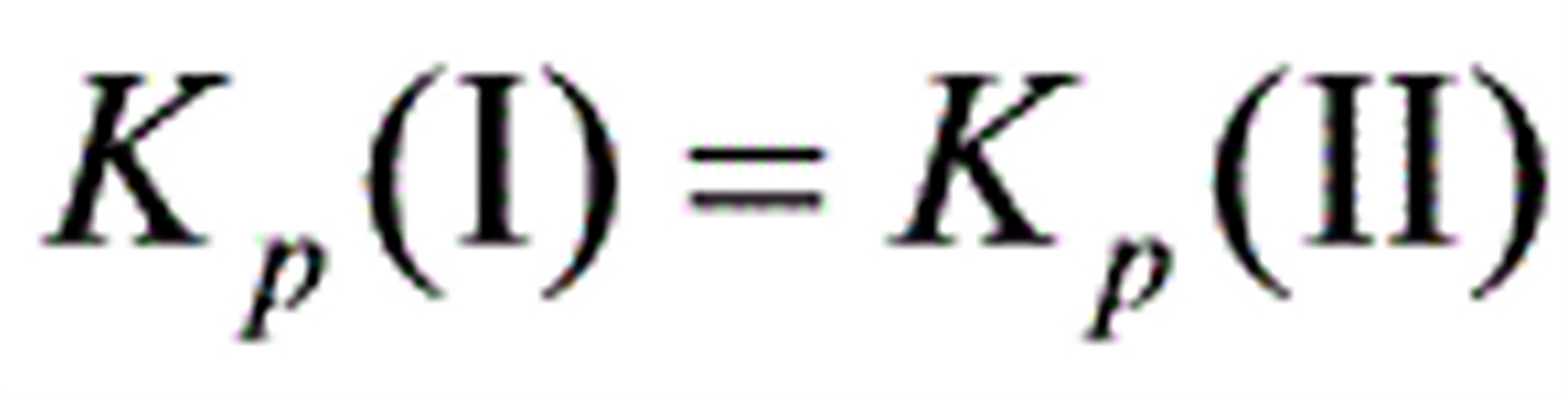 随温度降低而减小
随温度降低而减小
0623.某化学反应在298 K时的标准吉布斯自由能变化为负值,则该温度时反应的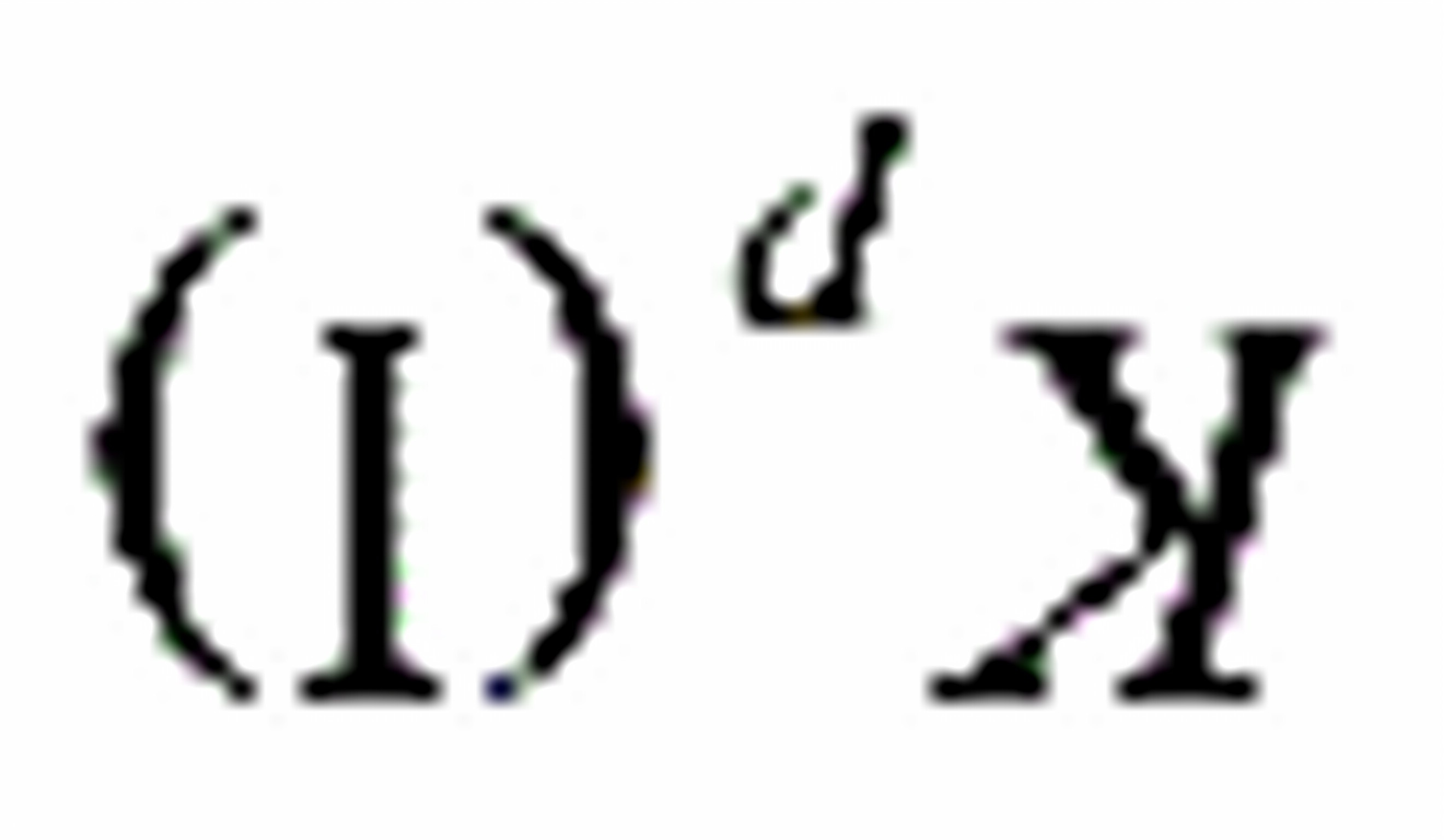 值将:
值将:
(A) (B)(C)(D)
(B)(C)(D)
0624.在一定温度和压力下,对于一个化学反应,能用以判断其反应方向的是:
(A)(B)(C)(D)
0625.对理想气体反应CO(g) + H2O(g) = H2(g) + CO2(g) ,下述关系正确的是:
(A) Kx< Kp(B) Kp= Kx(C) Kx= Kc(D) Kp< Kc
0626.下列平衡常数中,量纲为1的是:
(A)Kf,Kp,K(B)Kx,Kp,K(C)Kc,Ka,Kx(D),Ka,Kx
0627.已知分解反应NH2COONH4(s) = 2NH3(g) + CO2(g)在30℃时的平衡常数K= 0.000 655,则此时NH2COONH4(s)的分解压力为:
(A) 16630 Pa(B) 594000 Pa(C) 5542 Pa(D) 2928 Pa
0628.在温度为T,压力为p时,反应3O2(g)=2O3(g)的Kp与Kx的比值为
(A)RT(B)p(C)1/(RT)(D)1/p
0629.已知445℃时, Ag2O(s)的分解压力为20 974 kPa,则此时分解反应Ag2O(s)=2Ag(s)+(1/2)O2(g)的为:
(A) 14.387 J/mol(B) 15.92 kJ/mol(C) -15.92 kJ/mol(D) -31.83 kJ/mol
0630.反应2HgO(s)=2Hg(g) + O2(g)在101 325 Pa、分解温度时的分压p(Hg)等于:
(A) 101.325 kPa(B) (101.325 /2) kPa(C) (101.325 /3) kPa(D) (2/3)×101.325 kPa
0631.对一个理想气体化学反应的平衡常数与其标准吉布斯自由能变化的关系有:
(1)
(2)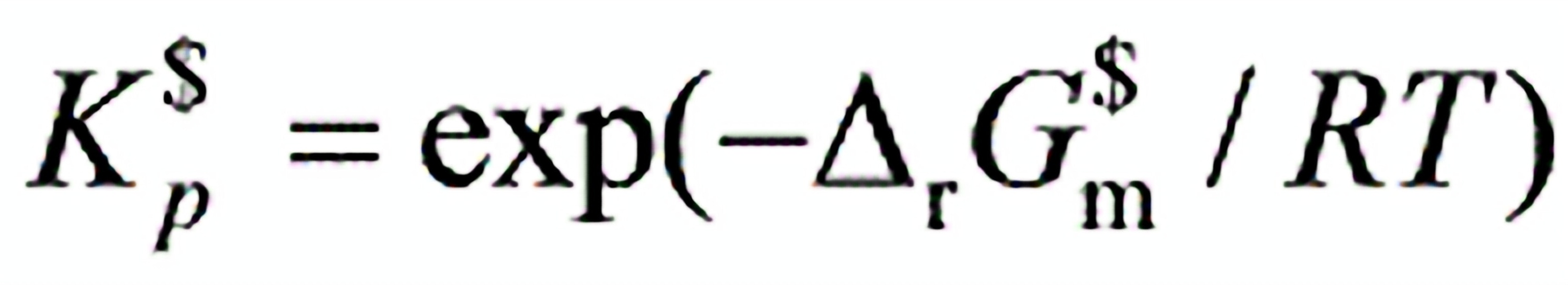
(3)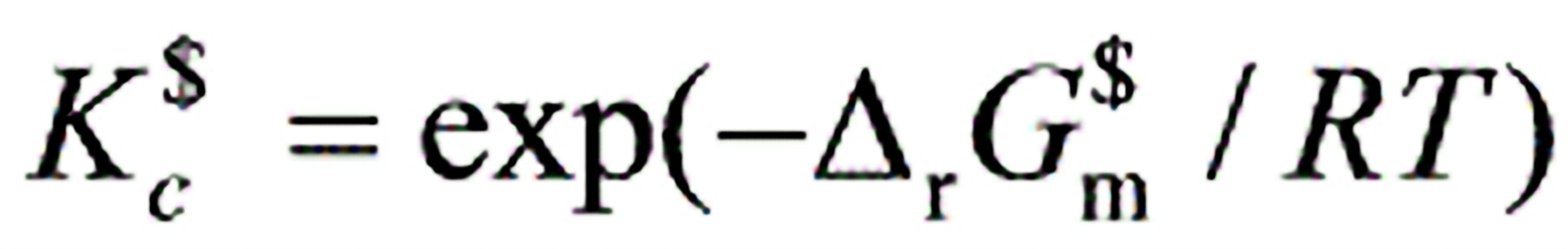 其中关系正确的是:
其中关系正确的是:
(A) (1)、(2)和(3)式均正确(B) (1)式正确(C) (2)式正确(D) (3)式正确
0632.理想气体化学反应平衡时,应用下列哪个关系式?
(A)(B)
(C)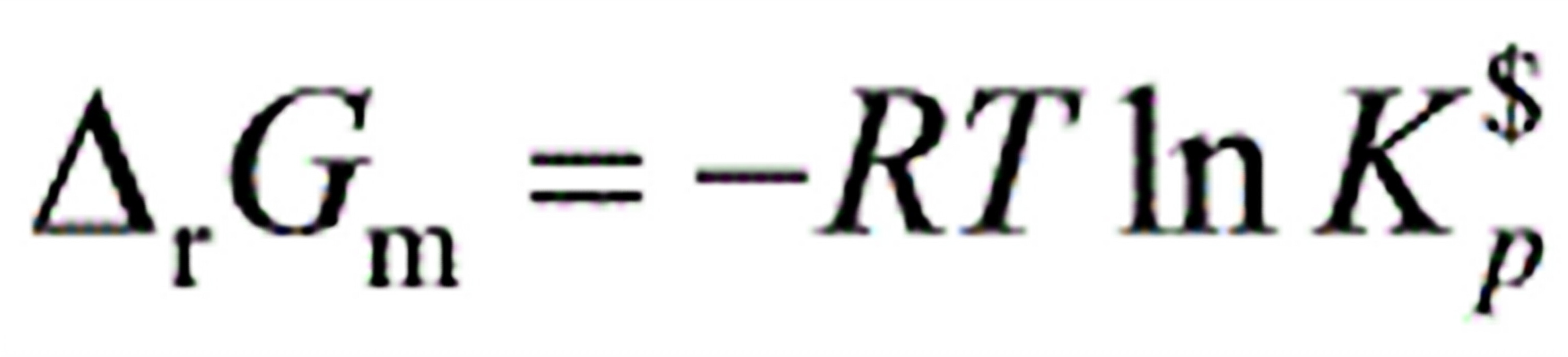 (D)
(D)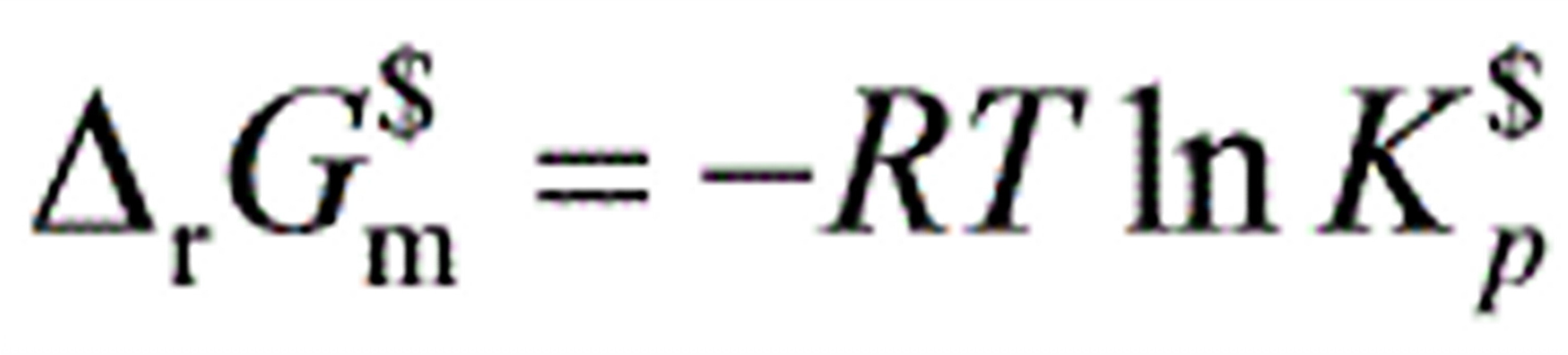
0633.在一定的温度下,一定量的PCl5(g)在一密闭容器中达到分解平衡PCl5(g)=PCl3(g) + Cl2(g)。若往容器中充入氮气,使体系的压力增加一倍(体积不变),则PCl5的解离度将:
(A)增加(B)减少(C)不变(D)不定
0634.在刚性密闭容器中,有下列理想气体的反应达到平衡A(g) + B(g)=C(g)若在恒温下加入一定量的惰性气体,则平衡将:
(A)向右移动(B)向左移动(C)不移动(D)无法确定
0635.PCl5的分解反应是PCl5(g)=PCl3(g) + Cl2(g),在473 K达到平衡时,PCl5(g)有48.5%分解,在573 K达到平衡时,有97%分解,则此反应为:
(A)放热反应(B)吸热反应
(C)即不放热也不吸热(D)这两个温度下的平衡常数相等
题目解答
答案
错误 不能确定