题目
14.已知CO(g)、CO2(g)的标准生成焓分别为 -110.5kJcdot (mol)^-1 -393.5kJcdot (mol)^-1, 则反应-|||-(g)+1/2(O)_(2)(g)=!=!= C(O)_(2)(g) 的热效应为 (kJcdot (mol)^-1)-|||-A.283 B. -283 C.141.5 D. -141.5

题目解答
答案
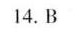
解析
步骤 1:理解标准生成焓
标准生成焓是指在标准状态下,由稳定单质生成1摩尔化合物时的焓变。题目中给出CO(g)和CO2(g)的标准生成焓分别为 $-110.5kJ\cdot {mol}^{-1}$ 和 $-393.5kJ\cdot {mol}^{-1}$。
步骤 2:应用盖斯定律
盖斯定律指出,化学反应的焓变与反应途径无关,只与反应物和生成物的状态有关。因此,反应 $CO(g)+1/2{O}_{2}(g)=\!=\!= C{O}_{2}(g)$ 的焓变可以通过标准生成焓的差值来计算。
步骤 3:计算焓变
反应的焓变 $\Delta H$ 可以通过生成物的生成焓减去反应物的生成焓来计算。即:
$$\Delta H = \Delta H_{生成物} - \Delta H_{反应物}$$
$$\Delta H = -393.5kJ\cdot {mol}^{-1} - (-110.5kJ\cdot {mol}^{-1})$$
$$\Delta H = -393.5kJ\cdot {mol}^{-1} + 110.5kJ\cdot {mol}^{-1}$$
$$\Delta H = -283kJ\cdot {mol}^{-1}$$
标准生成焓是指在标准状态下,由稳定单质生成1摩尔化合物时的焓变。题目中给出CO(g)和CO2(g)的标准生成焓分别为 $-110.5kJ\cdot {mol}^{-1}$ 和 $-393.5kJ\cdot {mol}^{-1}$。
步骤 2:应用盖斯定律
盖斯定律指出,化学反应的焓变与反应途径无关,只与反应物和生成物的状态有关。因此,反应 $CO(g)+1/2{O}_{2}(g)=\!=\!= C{O}_{2}(g)$ 的焓变可以通过标准生成焓的差值来计算。
步骤 3:计算焓变
反应的焓变 $\Delta H$ 可以通过生成物的生成焓减去反应物的生成焓来计算。即:
$$\Delta H = \Delta H_{生成物} - \Delta H_{反应物}$$
$$\Delta H = -393.5kJ\cdot {mol}^{-1} - (-110.5kJ\cdot {mol}^{-1})$$
$$\Delta H = -393.5kJ\cdot {mol}^{-1} + 110.5kJ\cdot {mol}^{-1}$$
$$\Delta H = -283kJ\cdot {mol}^{-1}$$