题目
铅酸电池是用途广泛并不断发展的化学电源。(1)十九世纪,铅酸电池工作原理初步形成并延续至今。铅酸电池工作原理:PbO2+Pb+2H2SO4⇌_(充电)^放电2PbSO4+2H2O①充电时,阴极发生的电极反应为 ____ 。②放电时,产生a库仑电量,消耗H2SO4的物质的量为 ____ mol。已知:转移1mol电子所产生的电量为96500库仑。③35%~40%H2SO4作为电解质溶液性质稳定、有较强的导电能力,(SO)_(4)^2-参与电极反应并有利于保持电压稳定。该体系中(SO)_(4)^2-不氧化Pb,(SO)_(4)^2-氧化性弱与其结构有关,(SO)_(4)^2-的空间结构是 ____ 。④铅酸电池储存过程中,存在化学能的缓慢消耗:PbO2电极在H2SO4作用下产生的O2可将Pb电极氧化。O2氧化Pb发生反应的化学方程式为 ____ 。(2)随着铅酸电池广泛应用,需要回收废旧电池材料,实现资源的再利用。回收过程中主要物质的转化关系示意图如图。H2O2、酸 含 (b)^2+ 电解 Pb-|||-废旧 预处理 PbSO NaOH溶液 Pb(OH) Ⅱ 溶液-|||-铅酸 PbO PbO-|||-电池 PbO I PbO K2S2O4、 强碱 PbO2-|||-Ⅲ①将PbSO4等物质转化为Pb2+的过程中,步骤Ⅰ加入NaOH溶液的目的是 ____ 。②步骤Ⅱ、Ⅲ中H2O2和K2S2O8作用分别是 ____ 。(3)铅酸电池使用过程中,负极因生成导电性差的大颗粒PbSO4,导致电极逐渐失活。通过向负极添加石墨、多孔碳等碳材料,可提高铅酸电池性能。碳材料的作用有 ____ (填序号)。a.增强负极导电性b.增大负极材料比表面积,利于生成小颗粒PbSO4c.碳材料作还原剂,使PbO2被还原
铅酸电池是用途广泛并不断发展的化学电源。
(1)十九世纪,铅酸电池工作原理初步形成并延续至今。
铅酸电池工作原理:PbO2+Pb+2H2SO4$⇌_{充电}^{放电}$2PbSO4+2H2O
①充电时,阴极发生的电极反应为 ____ 。
②放电时,产生a库仑电量,消耗H2SO4的物质的量为 ____ mol。
已知:转移1mol电子所产生的电量为96500库仑。
③35%~40%H2SO4作为电解质溶液性质稳定、有较强的导电能力,${SO}_{4}^{2-}$参与电极反应并有利于保持电压稳定。该体系中${SO}_{4}^{2-}$不氧化Pb,${SO}_{4}^{2-}$氧化性弱与其结构有关,${SO}_{4}^{2-}$的空间结构是 ____ 。
④铅酸电池储存过程中,存在化学能的缓慢消耗:PbO2电极在H2SO4作用下产生的O2可将Pb电极氧化。O2氧化Pb发生反应的化学方程式为 ____ 。
(2)随着铅酸电池广泛应用,需要回收废旧电池材料,实现资源的再利用。回收过程中主要物质的转化关系示意图如图。
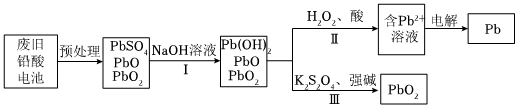
①将PbSO4等物质转化为Pb2+的过程中,步骤Ⅰ加入NaOH溶液的目的是 ____ 。
②步骤Ⅱ、Ⅲ中H2O2和K2S2O8作用分别是 ____ 。
(3)铅酸电池使用过程中,负极因生成导电性差的大颗粒PbSO4,导致电极逐渐失活。通过向负极添加石墨、多孔碳等碳材料,可提高铅酸电池性能。碳材料的作用有 ____ (填序号)。
a.增强负极导电性
b.增大负极材料比表面积,利于生成小颗粒PbSO4
c.碳材料作还原剂,使PbO2被还原
(1)十九世纪,铅酸电池工作原理初步形成并延续至今。
铅酸电池工作原理:PbO2+Pb+2H2SO4$⇌_{充电}^{放电}$2PbSO4+2H2O
①充电时,阴极发生的电极反应为 ____ 。
②放电时,产生a库仑电量,消耗H2SO4的物质的量为 ____ mol。
已知:转移1mol电子所产生的电量为96500库仑。
③35%~40%H2SO4作为电解质溶液性质稳定、有较强的导电能力,${SO}_{4}^{2-}$参与电极反应并有利于保持电压稳定。该体系中${SO}_{4}^{2-}$不氧化Pb,${SO}_{4}^{2-}$氧化性弱与其结构有关,${SO}_{4}^{2-}$的空间结构是 ____ 。
④铅酸电池储存过程中,存在化学能的缓慢消耗:PbO2电极在H2SO4作用下产生的O2可将Pb电极氧化。O2氧化Pb发生反应的化学方程式为 ____ 。
(2)随着铅酸电池广泛应用,需要回收废旧电池材料,实现资源的再利用。回收过程中主要物质的转化关系示意图如图。

①将PbSO4等物质转化为Pb2+的过程中,步骤Ⅰ加入NaOH溶液的目的是 ____ 。
②步骤Ⅱ、Ⅲ中H2O2和K2S2O8作用分别是 ____ 。
(3)铅酸电池使用过程中,负极因生成导电性差的大颗粒PbSO4,导致电极逐渐失活。通过向负极添加石墨、多孔碳等碳材料,可提高铅酸电池性能。碳材料的作用有 ____ (填序号)。
a.增强负极导电性
b.增大负极材料比表面积,利于生成小颗粒PbSO4
c.碳材料作还原剂,使PbO2被还原
题目解答
答案
(1)①充电时,阴极发生还原反应,电极反应式为:PbSO4+2e-= Pb+${SO}_{4}^{2-}$,
故答案为:PbSO4+2e-= Pb+${SO}_{4}^{2-}$;
②放电时,总反应中每转移2mol电子消耗2mol H2SO4,已知1mol电子对应96500库仑电量,产生a库仑电量时,转移电子的物质的量为$\frac{a}{96500}$mol,故消耗H2SO4的物质的量为:$\frac{a}{96500}$mol,
故答案为:$\frac{a}{96500}$;
③${SO}_{4}^{2}$⁻中S原子的价层电子对数为4,无孤对电子,其空间结构为:正四面体形,
故答案为:正四面体形;
④O2在H2SO4作用下氧化Pb的化学方程式为:2Pb+O2+2H2SO4= 2PbSO4+2H2O,
故答案为:2Pb+O2+2H2SO4= 2PbSO4+2H2O;
(2)①步骤Ⅰ加入NaOH溶液的目的是将PbSO4转化为易溶于酸的Pb(OH)2沉淀,反应为:PbSO4+2NaOH=Pb(OH)2↓+Na2SO4,便于后续酸溶得到Pb2+,
故答案为:将PbSO4转化为易溶于酸的Pb(OH)2沉淀,反应为:PbSO4+2NaOH=Pb(OH)2↓+Na2SO4,便于后续酸溶得到Pb2+;
②步骤Ⅱ中H2O2作还原剂,在酸性条件下将高价铅化合物(如PbO2)还原为低价态(如Pb2+);步骤Ⅲ中K2S2O8作强氧化剂,可能将Pb2+氧化为PbO2,或用于分解残留的有机物,
故答案为:作还原剂、作强氧化剂;
(3)a.增强负极导电性(石墨和多孔碳为良导体,改善电极导电性能),故a正确;
b.增大负极材料比表面积,利于生成小颗粒PbSO4(抑制大颗粒 PbSO4形成,延缓电极失活),故b正确;
c.负极的主要材料是Pb,且电解质环境为酸性,不能使PbO2被还原,故c错误;
故答案为:ab。
故答案为:PbSO4+2e-= Pb+${SO}_{4}^{2-}$;
②放电时,总反应中每转移2mol电子消耗2mol H2SO4,已知1mol电子对应96500库仑电量,产生a库仑电量时,转移电子的物质的量为$\frac{a}{96500}$mol,故消耗H2SO4的物质的量为:$\frac{a}{96500}$mol,
故答案为:$\frac{a}{96500}$;
③${SO}_{4}^{2}$⁻中S原子的价层电子对数为4,无孤对电子,其空间结构为:正四面体形,
故答案为:正四面体形;
④O2在H2SO4作用下氧化Pb的化学方程式为:2Pb+O2+2H2SO4= 2PbSO4+2H2O,
故答案为:2Pb+O2+2H2SO4= 2PbSO4+2H2O;
(2)①步骤Ⅰ加入NaOH溶液的目的是将PbSO4转化为易溶于酸的Pb(OH)2沉淀,反应为:PbSO4+2NaOH=Pb(OH)2↓+Na2SO4,便于后续酸溶得到Pb2+,
故答案为:将PbSO4转化为易溶于酸的Pb(OH)2沉淀,反应为:PbSO4+2NaOH=Pb(OH)2↓+Na2SO4,便于后续酸溶得到Pb2+;
②步骤Ⅱ中H2O2作还原剂,在酸性条件下将高价铅化合物(如PbO2)还原为低价态(如Pb2+);步骤Ⅲ中K2S2O8作强氧化剂,可能将Pb2+氧化为PbO2,或用于分解残留的有机物,
故答案为:作还原剂、作强氧化剂;
(3)a.增强负极导电性(石墨和多孔碳为良导体,改善电极导电性能),故a正确;
b.增大负极材料比表面积,利于生成小颗粒PbSO4(抑制大颗粒 PbSO4形成,延缓电极失活),故b正确;
c.负极的主要材料是Pb,且电解质环境为酸性,不能使PbO2被还原,故c错误;
故答案为:ab。