题目
将298K,100kPa的 _(2)2.00(dm)^3和398K,160kPa的He _(2)2.00(dm)^3都装到体积为 _(2)2.00(dm)^3的容器中,并使体系温度保持在298K.计算混合后 _(2)2.00(dm)^3与He的分压和混合气体的总压力.
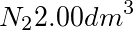 和398K,160kPa的He
和398K,160kPa的He
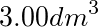 都装到体积为
都装到体积为
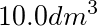 的容器中,并使体系温度保持在298K.计算混合后
的容器中,并使体系温度保持在298K.计算混合后
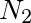 与He的分压和混合气体的总压力.
与He的分压和混合气体的总压力.
题目解答
答案
解:对于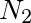 ,混合前后物质的量和温度保持不变,故根据波义耳定律有
,混合前后物质的量和温度保持不变,故根据波义耳定律有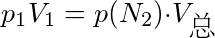
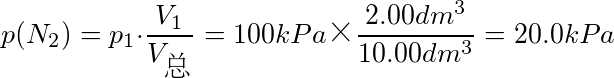
对于He,混合前后气体的温度、压强和体积发生变化.由理想气体的状态方程pV=nRT得
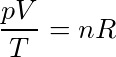
该式说明,一定量的气体发生状态变化时,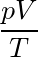 的值保持不变.故
的值保持不变.故
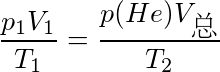
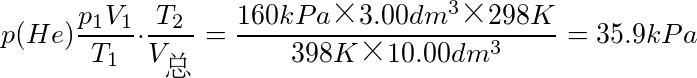
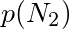 和p(He)分别为混合后体系中组分气体的分压.根据道尔顿分压定律,有
和p(He)分别为混合后体系中组分气体的分压.根据道尔顿分压定律,有
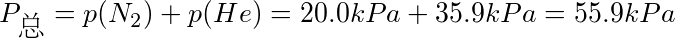
故混合后体系的总压为55.9kPa.
解析
步骤 1:计算氮气(${N}_{2}$)的分压
根据波义耳定律,混合前后氮气的物质的量和温度保持不变,因此有:
${p}_{1}{V}_{1}=p({N}_{2})·{V}_{总}$
其中,${p}_{1}$是氮气的初始压力,${V}_{1}$是氮气的初始体积,${V}_{总}$是混合后的总体积,$p({N}_{2})$是氮气的分压。
步骤 2:计算氦气(He)的分压
根据理想气体状态方程,混合前后氦气的温度、压强和体积发生变化,因此有:
$\frac{{p}_{1}{V}_{1}}{T_{1}}=\frac{p(He){V}_{总}}{{T}_{2}}$
其中,${p}_{1}$是氦气的初始压力,${V}_{1}$是氦气的初始体积,${T}_{1}$是氦气的初始温度,${T}_{2}$是混合后的温度,$p(He)$是氦气的分压。
步骤 3:计算混合气体的总压力
根据道尔顿分压定律,混合气体的总压力等于各组分气体的分压之和,即:
${P}_{总}=p({N}_{2})+p(He)$
根据波义耳定律,混合前后氮气的物质的量和温度保持不变,因此有:
${p}_{1}{V}_{1}=p({N}_{2})·{V}_{总}$
其中,${p}_{1}$是氮气的初始压力,${V}_{1}$是氮气的初始体积,${V}_{总}$是混合后的总体积,$p({N}_{2})$是氮气的分压。
步骤 2:计算氦气(He)的分压
根据理想气体状态方程,混合前后氦气的温度、压强和体积发生变化,因此有:
$\frac{{p}_{1}{V}_{1}}{T_{1}}=\frac{p(He){V}_{总}}{{T}_{2}}$
其中,${p}_{1}$是氦气的初始压力,${V}_{1}$是氦气的初始体积,${T}_{1}$是氦气的初始温度,${T}_{2}$是混合后的温度,$p(He)$是氦气的分压。
步骤 3:计算混合气体的总压力
根据道尔顿分压定律,混合气体的总压力等于各组分气体的分压之和,即:
${P}_{总}=p({N}_{2})+p(He)$