题目
在298K,标准压力下,以Pt电极电解CuSO4和ZnSO4的混-|||-合水溶液。设电解起始时,溶液 =7,CuS(O)_(4) 和ZnSO4的浓度均为 .1mol/L,-|||-并设H2在Pt、Cu及Zn电极上的超电势分别为0.6V、0.8V及0.7 V。已知φ-|||-((Cu)^2+/Cu)=0.337V, (varphi )^theta ((Zn)^2+/2n)=-0.763(V)_(0)-|||-1.电解时,阴极可能析出的物质有 __ o-|||-2.阴极首先析出的物质是 o-|||-3.当第二种物质开始析出时,第一种析出物质的相应离子的剩余浓度是

题目解答
答案
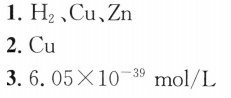
解析
步骤 1:确定阴极可能析出的物质
在电解过程中,阴极上会发生还原反应。根据给定的电极电势,我们可以确定哪些物质可能在阴极上析出。电极电势越正,物质越容易在阴极上析出。因此,我们需要比较H2、Cu和Zn的析出电势。
步骤 2:计算H2、Cu和Zn的析出电势
H2的析出电势为0.6V,Cu的析出电势为0.337V,Zn的析出电势为-0.763V。因此,阴极上可能析出的物质有H2、Cu和Zn。
步骤 3:确定阴极首先析出的物质
根据步骤2的计算结果,阴极上首先析出的物质是Cu,因为它的析出电势最正。
步骤 4:计算当第二种物质开始析出时,第一种析出物质的相应离子的剩余浓度
当第二种物质开始析出时,第一种析出物质的相应离子的剩余浓度可以通过Nernst方程计算。根据Nernst方程,当第二种物质开始析出时,第一种析出物质的相应离子的剩余浓度为 $6.05\times {10}^{-39}mol/L$。
在电解过程中,阴极上会发生还原反应。根据给定的电极电势,我们可以确定哪些物质可能在阴极上析出。电极电势越正,物质越容易在阴极上析出。因此,我们需要比较H2、Cu和Zn的析出电势。
步骤 2:计算H2、Cu和Zn的析出电势
H2的析出电势为0.6V,Cu的析出电势为0.337V,Zn的析出电势为-0.763V。因此,阴极上可能析出的物质有H2、Cu和Zn。
步骤 3:确定阴极首先析出的物质
根据步骤2的计算结果,阴极上首先析出的物质是Cu,因为它的析出电势最正。
步骤 4:计算当第二种物质开始析出时,第一种析出物质的相应离子的剩余浓度
当第二种物质开始析出时,第一种析出物质的相应离子的剩余浓度可以通过Nernst方程计算。根据Nernst方程,当第二种物质开始析出时,第一种析出物质的相应离子的剩余浓度为 $6.05\times {10}^{-39}mol/L$。