题目
某研究性学习小组的同学利用如图所示装置探究浓硝酸与铁反应的产物(加热及夹持装置均已略去)。已知:FeSO4(aq)+NO(g) Fe(NO)SO4(aq)(棕色)△H<0;NO2和NO都能被酸性KMnO4溶液氧化吸收。8 浓硝酸-|||-CO 气体收集装置-|||-弹簧夹 点-|||-Fe片-|||-FeSO4酸性KMnO4-|||-溶液 溶液-|||-A B C实验操作和现象如表所示: 实验操作 实验现象 打开弹簧夹,通入一段时间CO2,关闭弹簧夹 打开分液漏斗旋塞,将浓硝酸缓慢滴入烧瓶中,关闭旋塞 无明显现象 加热烧瓶,反应开始后停止加热 ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅②反应停止后,A中无固体剩余,并得100mL溶液 请回答下列问题:(1)加热前滴入浓硝酸没有明显现象的原因是 ____ 。(2)实验操作中通入CO2的主要目的是 ____ 。(3)取少量B中溶液,加热,实验现象是 ____ 。甲依据该现象得出的结论是A中有NO生成。A.棕色溶液变浅绿色 B.棕色溶液变无色C.有红棕色气体逸出 D.有无色气体逸出 E.产生红褐色沉淀(4)某同学认为A中有NO生成的证据不足。为获取充足的证据,该同学仍采用该装置和操作进行对照实验,但将浓硝酸换成稀硝酸,则证明有NO生成的实验现象是A中 ____ ,B中 ____ 。(5)溶A中换为用铜片和浓硝酸反应制备物质的量为1:1的NO和NO2的混合气体,请写出此反应的离子方程式 ____ 。(6)若A中所得溶液稀释至500mL,取少量稀释后的溶液调节pH,滴加铁氰化钾溶液有蓝色沉淀生成。另取稀释后的溶液25.00mL 加入过量的KI固体,充分反应后调pH至7左右,滴入几滴淀粉溶液作指示剂,用0.25mol/L Na2S2O3标准液滴定至终点,共消耗Na2S2O3标准溶液16.00mL,则A中所得溶液中c(Fe3+)= ____ mol/L.(已知:I2+2S2O32‾=2I‾+S4O62‾)
某研究性学习小组的同学利用如图所示装置探究浓硝酸与铁反应的产物(加热及夹持装置均已略去)。已知:FeSO4(aq)+NO(g) Fe(NO)SO4(aq)(棕色)△H<0;NO2和NO都能被酸性KMnO4溶液氧化吸收。
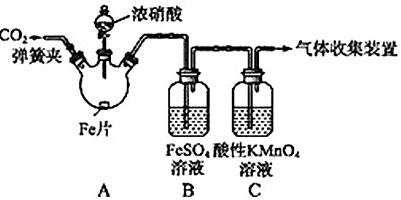
实验操作和现象如表所示:
请回答下列问题:
(1)加热前滴入浓硝酸没有明显现象的原因是 ____ 。
(2)实验操作中通入CO2的主要目的是 ____ 。
(3)取少量B中溶液,加热,实验现象是 ____ 。甲依据该现象得出的结论是A中有NO生成。
A.棕色溶液变浅绿色 B.棕色溶液变无色C.有红棕色气体逸出 D.有无色气体逸出 E.产生红褐色沉淀
(4)某同学认为A中有NO生成的证据不足。为获取充足的证据,该同学仍采用该装置和操作进行对照实验,但将浓硝酸换成稀硝酸,则证明有NO生成的实验现象是A中 ____ ,B中 ____ 。
(5)溶A中换为用铜片和浓硝酸反应制备物质的量为1:1的NO和NO2的混合气体,请写出此反应的离子方程式 ____ 。
(6)若A中所得溶液稀释至500mL,取少量稀释后的溶液调节pH,滴加铁氰化钾溶液有蓝色沉淀生成。另取稀释后的溶液25.00mL 加入过量的KI固体,充分反应后调pH至7左右,滴入几滴淀粉溶液作指示剂,用0.25mol/L Na2S2O3标准液滴定至终点,共消耗Na2S2O3标准溶液16.00mL,则A中所得溶液中c(Fe3+)= ____ mol/L.(已知:I2+2S2O32‾=2I‾+S4O62‾)

实验操作和现象如表所示:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹 | |
| 打开分液漏斗旋塞,将浓硝酸缓慢滴入烧瓶中,关闭旋塞 | 无明显现象 |
| 加热烧瓶,反应开始后停止加热 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅 ②反应停止后,A中无固体剩余,并得100mL溶液 |
(1)加热前滴入浓硝酸没有明显现象的原因是 ____ 。
(2)实验操作中通入CO2的主要目的是 ____ 。
(3)取少量B中溶液,加热,实验现象是 ____ 。甲依据该现象得出的结论是A中有NO生成。
A.棕色溶液变浅绿色 B.棕色溶液变无色C.有红棕色气体逸出 D.有无色气体逸出 E.产生红褐色沉淀
(4)某同学认为A中有NO生成的证据不足。为获取充足的证据,该同学仍采用该装置和操作进行对照实验,但将浓硝酸换成稀硝酸,则证明有NO生成的实验现象是A中 ____ ,B中 ____ 。
(5)溶A中换为用铜片和浓硝酸反应制备物质的量为1:1的NO和NO2的混合气体,请写出此反应的离子方程式 ____ 。
(6)若A中所得溶液稀释至500mL,取少量稀释后的溶液调节pH,滴加铁氰化钾溶液有蓝色沉淀生成。另取稀释后的溶液25.00mL 加入过量的KI固体,充分反应后调pH至7左右,滴入几滴淀粉溶液作指示剂,用0.25mol/L Na2S2O3标准液滴定至终点,共消耗Na2S2O3标准溶液16.00mL,则A中所得溶液中c(Fe3+)= ____ mol/L.(已知:I2+2S2O32‾=2I‾+S4O62‾)
题目解答
答案
解:(1)常温时,铁和浓硝酸反应生成一层致密的氧化物薄膜,阻止了铁和浓硝酸进一步反应,即产生钝化现象,所以滴入浓硝酸加热前没有明显现象,
故答案为:常温下,铁遇浓硝酸发生钝化;
(2)甲的实验操作中通入CO2的主要目的是排除反应体系中的空气,防止干扰,
故答案为:排除反应体系中的空气,防止干扰试验;
(3)取少量B中溶液,加热,棕色溶于变浅,有无色气体逸出,且该气体在空气中变为红棕色,应为可逆反应FeSO4+NO⇌Fe(NO)SO4(棕色)是放热反应,升高温度,平衡向逆反应方向移动,导致Fe(NO)SO4(棕色)降低,所以溶液颜色变浅,
故答案为:AD;
(4)二氧化氮和水反应生成的一氧化氮能使硫酸亚铁溶液变成棕色,所以不能证明铁和浓硝酸反应过程中NO生成,为排除生成的NO干扰,把浓硝酸换成稀硝酸,稀硝酸和铜反应生成无色的一氧化氮,没有二氧化氮生成,则A中气体是无色的,且B中溶液变为棕色,则说明生成的一氧化氮和硫酸亚铁反应生成棕色,从而说明A中无色气体是一氧化氮,
故答案为:没有红棕色气体生成;溶液变为棕色;
(5)铜片和某浓度的硝酸制备物质的量之比为1:1的NO和NO2的混合气体,氮元素+5价变化为+2价和+4价,电子转移总数4mol时消耗铜物质的量为2mol,结合电荷守恒和原子守恒配平书写得到离子方程式为:2Cu+2NO3-+6H+=2Cu2++NO↑+NO2↑+3H2O,
故答案为:2Cu+2NO3-+6H+=2Cu2++NO↑+NO2↑+3H2O;
(6)Fe2+和铁氰化钾溶液反应3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀),生成特征蓝色沉淀,所以由此证明A溶液中含有Fe2+,I2+2S2O32-=2I-+S4O62-,2Fe3++2I-=2Fe2++I2;
2S2O32-~I2~2 Fe3+;
2 2
0.25×16×10-3mol n(Fe3+)
n(Fe3+)=4×10-3mol,
25ml溶液中铁离子物质的量=4×10-3mol,
500ml溶液中铁离子物质的量4×10-3mol×$\frac{500}{25}$=0.08mol,
则A中所得溶液的c(Fe3+)=$\frac{0.08mol}{0.1L}$=0.8mol/L,
故答案为:0.8。
故答案为:常温下,铁遇浓硝酸发生钝化;
(2)甲的实验操作中通入CO2的主要目的是排除反应体系中的空气,防止干扰,
故答案为:排除反应体系中的空气,防止干扰试验;
(3)取少量B中溶液,加热,棕色溶于变浅,有无色气体逸出,且该气体在空气中变为红棕色,应为可逆反应FeSO4+NO⇌Fe(NO)SO4(棕色)是放热反应,升高温度,平衡向逆反应方向移动,导致Fe(NO)SO4(棕色)降低,所以溶液颜色变浅,
故答案为:AD;
(4)二氧化氮和水反应生成的一氧化氮能使硫酸亚铁溶液变成棕色,所以不能证明铁和浓硝酸反应过程中NO生成,为排除生成的NO干扰,把浓硝酸换成稀硝酸,稀硝酸和铜反应生成无色的一氧化氮,没有二氧化氮生成,则A中气体是无色的,且B中溶液变为棕色,则说明生成的一氧化氮和硫酸亚铁反应生成棕色,从而说明A中无色气体是一氧化氮,
故答案为:没有红棕色气体生成;溶液变为棕色;
(5)铜片和某浓度的硝酸制备物质的量之比为1:1的NO和NO2的混合气体,氮元素+5价变化为+2价和+4价,电子转移总数4mol时消耗铜物质的量为2mol,结合电荷守恒和原子守恒配平书写得到离子方程式为:2Cu+2NO3-+6H+=2Cu2++NO↑+NO2↑+3H2O,
故答案为:2Cu+2NO3-+6H+=2Cu2++NO↑+NO2↑+3H2O;
(6)Fe2+和铁氰化钾溶液反应3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀),生成特征蓝色沉淀,所以由此证明A溶液中含有Fe2+,I2+2S2O32-=2I-+S4O62-,2Fe3++2I-=2Fe2++I2;
2S2O32-~I2~2 Fe3+;
2 2
0.25×16×10-3mol n(Fe3+)
n(Fe3+)=4×10-3mol,
25ml溶液中铁离子物质的量=4×10-3mol,
500ml溶液中铁离子物质的量4×10-3mol×$\frac{500}{25}$=0.08mol,
则A中所得溶液的c(Fe3+)=$\frac{0.08mol}{0.1L}$=0.8mol/L,
故答案为:0.8。