水杨酸(邻羟基苯甲酸,C7H6O3)是二元酸,Ka1=1.06×10-3,Ka2=3.6×10-14,它是一种消毒防腐剂,有时可用作止痛药而代替阿司匹林,但它有较强的酸性,能引起胃出血。计算0.065 mol?L-1的C7H6O3溶液的pH值及平衡时各物种的浓度。
水杨酸(邻羟基苯甲酸,C7H6O3)是二元酸,Ka1=1.06×10-3,Ka2=3.6×10-14,它是一种消毒防腐剂,有时可用作止痛药而代替阿司匹林,但它有较强的酸性,能引起胃出血。计算0.065 mol?L-1的C7H6O3溶液的pH值及平衡时各物种的浓度。
题目解答
答案
解 ∵Ka2很小,可忽略第二级H3O+的解离。但c/Ka1<500
C7H6O3(aq) + H2O(l)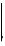
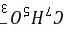 (aq) + H3O+(aq)
(aq) + H3O+(aq)
初始浓度/(mol·L-1) 0.065
平衡浓度/(mol·L-1) 0.065-x x x
x=7.8×10-3,[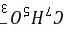 ]≈[H3O+]=7.8×10-3 mol·L-1,pH=2.11
]≈[H3O+]=7.8×10-3 mol·L-1,pH=2.11
[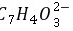 ]≈Ka2,即[
]≈Ka2,即[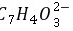 ]=3.6×10-14 mol·L-1
]=3.6×10-14 mol·L-1
解析
考查要点:本题主要考查二元弱酸在水溶液中的分步解离平衡计算,重点在于判断各步解离的贡献及合理简化假设。
解题核心思路:
- 分步解离:水杨酸为二元酸,需考虑两步解离,但第二步解离常数$K_a2$极小,可忽略其对$[H_3O^+]$的贡献。
- 近似条件判断:通过比较初始浓度$c$与$K_a1$的比值($c/K_a1 \approx 61.3 < 500$),确定不能直接使用强弱酸混合公式,需解二次方程求解第一步解离平衡。
- 简化假设:第二步解离产生的$[C_7H_4O_3^{2-}]$浓度极低,直接由$K_a2$和第一步解离产物浓度估算。
第一步解离平衡计算
水杨酸第一步解离方程为:
$C_7H_6O_3 + H_2O \rightleftharpoons C_7H_5O_3^- + H_3O^+$
设平衡时解离度为$x$,列平衡浓度表:
| 物质 | 初始浓度 | 平衡浓度 |
|---|---|---|
| $C_7H_6O_3$ | 0.065 | $0.065 - x$ |
| $C_7H_5O_3^-$ | 0 | $x$ |
| $H_3O^+$ | 0 | $x$ |
根据$K_a1$表达式:
$K_a1 = \frac{x^2}{0.065 - x} = 1.06 \times 10^{-3}$
解二次方程得$x \approx 7.8 \times 10^{-3}$ mol/L,即:
$[H_3O^+] = [C_7H_5O_3^-] = 7.8 \times 10^{-3} \, \text{mol/L}$
第二步解离平衡计算
第二步解离方程为:
$C_7H_5O_3^- + H_2O \rightleftharpoons C_7H_4O_3^{2-} + H_3O^+$
因$K_a2 = 3.6 \times 10^{-14}$极小,第二步解离对$[H_3O^+]$贡献可忽略,直接由$K_a2$估算:
$[C_7H_4O_3^{2-}] \approx K_a2 = 3.6 \times 10^{-14} \, \text{mol/L}$
pH值计算
$pH = -\log[H_3O^+] = -\log(7.8 \times 10^{-3}) \approx 2.11$