题目
用重量法测定As2 O3的含量时,将As 2O3在碱性溶液中转变为 (As{O)_(4)}^3-, 并沉淀为-|||-Ag3AsO4,随后在HNO3 介质中转变为AgCl沉淀,并以AgCl称量。其化学因数为 ()-|||-A. _({As)_(2)(O)_(3)}/6(M)_(AgCl) B. (M)_({As)_(2)(O)_(3)/3(M)_(Ag{Cl)_(1)}-|||-C. _(A{S)_(2)}(O)_(3)/(M)_(AgCl) D. (M)_(Ag{Cl)_(1)}/6(M)_({A{S)_(2)}(O)_(3)

题目解答
答案
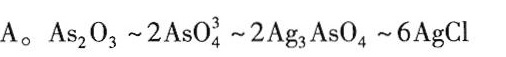
解析
考查要点:本题主要考查重量分析法中化学因数的计算,涉及化学反应的连续变化及物质的量关系。
解题核心思路:
- 明确反应流程:As₂O₃ → AsO₄³⁻ → Ag₃AsO₄ → AgCl。
- 建立物质的量关系:通过化学反应方程式,确定As₂O₃与AgCl的摩尔比。
- 化学因数公式:化学因数 = $\frac{\text{As₂O₃的摩尔质量}}{\text{AgCl的摩尔数} \times \text{AgCl的摩尔质量}}$。
破题关键点:
- 反应配平:As₂O₃转化为2 mol AsO₄³⁻,每mol AsO₄³⁻需3 mol Ag⁺生成Ag₃AsO₄。
- 最终产物关系:2 mol Ag₃AsO₄释放6 mol Ag⁺,最终生成6 mol AgCl。
反应流程与物质的量关系
-
As₂O₃转化为AsO₄³⁻
$\text{As₂O₃} \rightarrow 2\text{AsO₄³⁻}$
1 mol As₂O₃生成2 mol AsO₄³⁻。 -
AsO₄³⁻沉淀为Ag₃AsO₄
$\text{Ag⁺} + \text{AsO₄³⁻} \rightarrow \text{Ag₃AsO₄}$
每mol AsO₄³⁻需3 mol Ag⁺,2 mol AsO₄³⁻需6 mol Ag⁺,生成2 mol Ag₃AsO₄。 -
Ag₃AsO₄转化为AgCl
$\text{Ag₃AsO₄} + \text{Cl⁻} \rightarrow 3\text{AgCl} + \text{其他产物}$
2 mol Ag₃AsO₄释放6 mol Ag⁺,最终生成6 mol AgCl。
化学因数计算
化学因数为:
$\frac{M_{\text{As₂O₃}}}{6M_{\text{AgCl}}}$
对应选项 A。