:K2[Co(II)Cl2I2(NH3)2](注:异构现象见正文MA2B2C2型八面体配合物异构)9-12实验证实,Fe(H2O)63+ 和Fe(CN) 63- 的磁矩差别极大,如何用价键理论来理?9-13上题的事实用晶体场理论又作如何理?9-14用晶体场理论定性地说明二价和三价铁的水合离子的颜色不同的原因。9-15利用表4-1 ﹑表4-2 ﹑表4-4 的数据确定表中配合物的未成对电子数。9-16利用表4-1 ﹑表4-2数据计算表4-1 ﹑表4-2中的离子的稳定化能,并定性说明它们的稳定化能差别的原因。9-17以 d 电子数为横坐标,以稳定化能为纵坐标,利用表2的数据制作第四周期元素的水合离子M(H2O)62+ 离子的稳定化能曲线。9-18总结本章课文里涉及的配合物的实用价值。9-19 阅读课外报纸杂志或从网络获取信息做一个有关配合物在日常生活﹑工农业生产中的应用的读书报告。9-20查阅有关配合滴定的书籍后用一个或几个通式表示配合滴定达到滴定终点时发生什么化学反应?为什么配合滴定的终点会发生溶液颜色的突变?9-21查阅第18届国际化学奥林匹克竞赛(荷兰莱顿1986)的试题。你不看答案能不能出该试卷中有关铂的抗癌机理的那道试题?试一试。9-22利用棉花﹑橡皮泥﹑铁丝等原料动手制作晶体场理论对八面题配合物中心原子d轨道与配体的空间关系模型,以加强对晶体场理论关键内容——中心原子d轨道分裂的理。25、第二组是不可存在的1-26 以下能级的角量子数多大?(a)1s (b)1p (c)4d (d)2d (e)3p (f)3f25、第二组是不可存在的1-27 4s﹑5p﹑6d﹑7f﹑5g 能级各有几个轨道?25、第二组是不可存在的1-28 根据原子序数给出下列元素的基态原子的核外电子组态:A. K B. Al C. Cl D. Ti(Z=22) E. Zn(Z=30) F. As(Z=33) G. 25、第二组是不可存在的1-29 若构造原理对新合成的及未合成的人造元素仍有效,请预言第118和166号元素在周期表中的位置(注:1999年美国宣布合成了118 号元素及其衰变产物116号元素,但2001年因不能重复而收回该报道)。25、第二组是不可存在的BeNFCl-Ne+Fe3+As3+25、第二组是不可存在的1-31 下列哪些组态符合洪特规则?1s 2s 2p 3s 3p↑↓ ↑↓ ↑↓ ↓↓↑↓ ↑↓ ↑ ↑ ↑↑↓ ↑↓ ↑↓ ↑↓↑↓ ↑↑↑↑25、第二组是不可存在的25、第二组是不可存在的1-32 以下哪些原子或离子的电子组态是基态﹑激发态还是不可能的组态?1s22s21s23s1 1s23d3 (d)[Ne]3s23d1 (e)[Ar]3d24s2 (f)1s22s22p63s1 (g)[Ne]3s23d12 (f)[Xe]4f7 ( g)[Ar]3d625、第二组是不可存在的Li+ ﹑Na+﹑K+ ﹑Rb+﹑Cs+ 的基态的最外层电子组态与次外层电子组态分别如何?25、第二组是不可存在的l3+ , Ga3+,i3+, Mn3+, Se3+25、第二组是不可存在的1-35已知电中性的基态原子的价电子层电子组态分别为:3s23p5(b)3d64s2(c)5s2(d)4f96s2(e)5d106s1Jensen 合成了一种配合物,化学式为 Ni[P(C2H5)3]3Br ,该化合物呈顺磁性,有极性,但难溶于水而易溶于苯,其苯溶液不导电。试画出这种配合物的所有可能结构,若有对映异构体需标明对映关系。9-24以下说法对不对?简述理由。e3+ 的颜色e(CNS)n3-n 的n越大,离子的颜色越深。(3)配合物中配体的数目称为配位数。(4)配位化合物的中心原子的氧化态不可能等于零,更不可能为负值。O 是用氧原子和中心原子结合的,因为氧的电负性比碳大。(6)同一种金属元素的配合物的磁性决定于该元素的氧化态,氧化态越高,磁矩就越大。o(en)33-没有立体异构体。Ti(CN)63- 的颜色比TiCl63- 的颜色深。Ni2+ 的六配位八面体配合物按磁矩的大小可分为高自旋和低自旋两种。(10)晶体场稳定化能为零的配合物是不稳定的。CD-Chemsketch 制作穴醚 N(CH2CH2OCH2CH2OCH2CH2)3 N的三维,用该程序优化后计算该配体的内径大小,再查出碱金属离子的半径,估计该穴醚能否容纳碱金属离子。9-26 4-23是晶体场理论中平面四配位(右)跟八面体配位(左)的d轨道分裂对比。(1)设平面结构的四个配体是以x和y轴的方向向中心原子靠拢的,试定性地说明为什么八面体结构中的dr 轨道组在平面四配位结构中会分为两组?并给出后者能量最高的d轨道的符号。(2)定性地说明八面体结构中的 d∈ 轨道组在平面四边形结构中也会变为两组,并给出后者能量最低的d轨道的符号。N)42-的磁矩,并与价键轨道理论的估计相对比。(4)实验证实镍的所有平面四边形配合物都是低自旋的,从上应如何释该事实?9-27实验测得一些配合物的磁矩如下,由该实验事实预言这些配合物中心原子的未成对电子数﹑ 杂化轨道类型﹑ 配合物的空间结构类型﹑属价键理论的内轨型还是外轨型﹑ 属晶体场理论的高自旋还是低自旋?[Fe(en)3]2+ 5.5 B M [Co(SCN)4] 2- 4.3 B M [Mn(CN)4] 2- 1.8 B M[FeF6] 3- 5.9 B M [Ni(CN)4] 2- 0 B M [Ni(NH3)6] 2+ 3.2 B M
:K2[Co(II)Cl2I2(NH3)2](注:异构现象见正文MA2B2C2型八面体配合物异构)
9-12实验证实,Fe(H2O)63+ 和Fe(CN) 63- 的磁矩差别极大,如何用价键理论来理?
9-13上题的事实用晶体场理论又作如何理?
9-14用晶体场理论定性地说明二价和三价铁的水合离子的颜色不同的原因。
9-15利用表4-1 ﹑表4-2 ﹑表4-4 的数据确定表中配合物的未成对电子数。
9-16利用表4-1 ﹑表4-2数据计算表4-1 ﹑表4-2中的离子的稳定化能,并定性说明它们的稳定化能差别的原因。
9-17以 d 电子数为横坐标,以稳定化能为纵坐标,利用表2的数据制作第四周期元素的水合离子M(H2O)62+ 离子的稳定化能曲线。
9-18总结本章课文里涉及的配合物的实用价值。
9-19 阅读课外报纸杂志或从网络获取信息做一个有关配合物在日常生活﹑工农业生产中的应用的读书报告。
9-20查阅有关配合滴定的书籍后用一个或几个通式表示配合滴定达到滴定终点时发生什么化学反应?为什么配合滴定的终点会发生溶液颜色的突变?
9-21查阅第18届国际化学奥林匹克竞赛(荷兰莱顿1986)的试题。你不看答案能不能出该试卷中有关铂的抗癌机理的那道试题?试一试。
9-22利用棉花﹑橡皮泥﹑铁丝等原料动手制作晶体场理论对八面题配合物中心原子d轨道与配体的空间关系模型,以加强对晶体场理论关键内容——中心原子d轨道分裂的理。
1-26 以下能级的角量子数多大?(a)1s (b)1p (c)4d (d)2d (e)3p (f)3f

1-27 4s﹑5p﹑6d﹑7f﹑5g 能级各有几个轨道?

1-28 根据原子序数给出下列元素的基态原子的核外电子组态:
A. KB. Al
C. Cl
D. Ti(Z=22)
E. Zn(Z=30)
F. As(Z=33)
G.
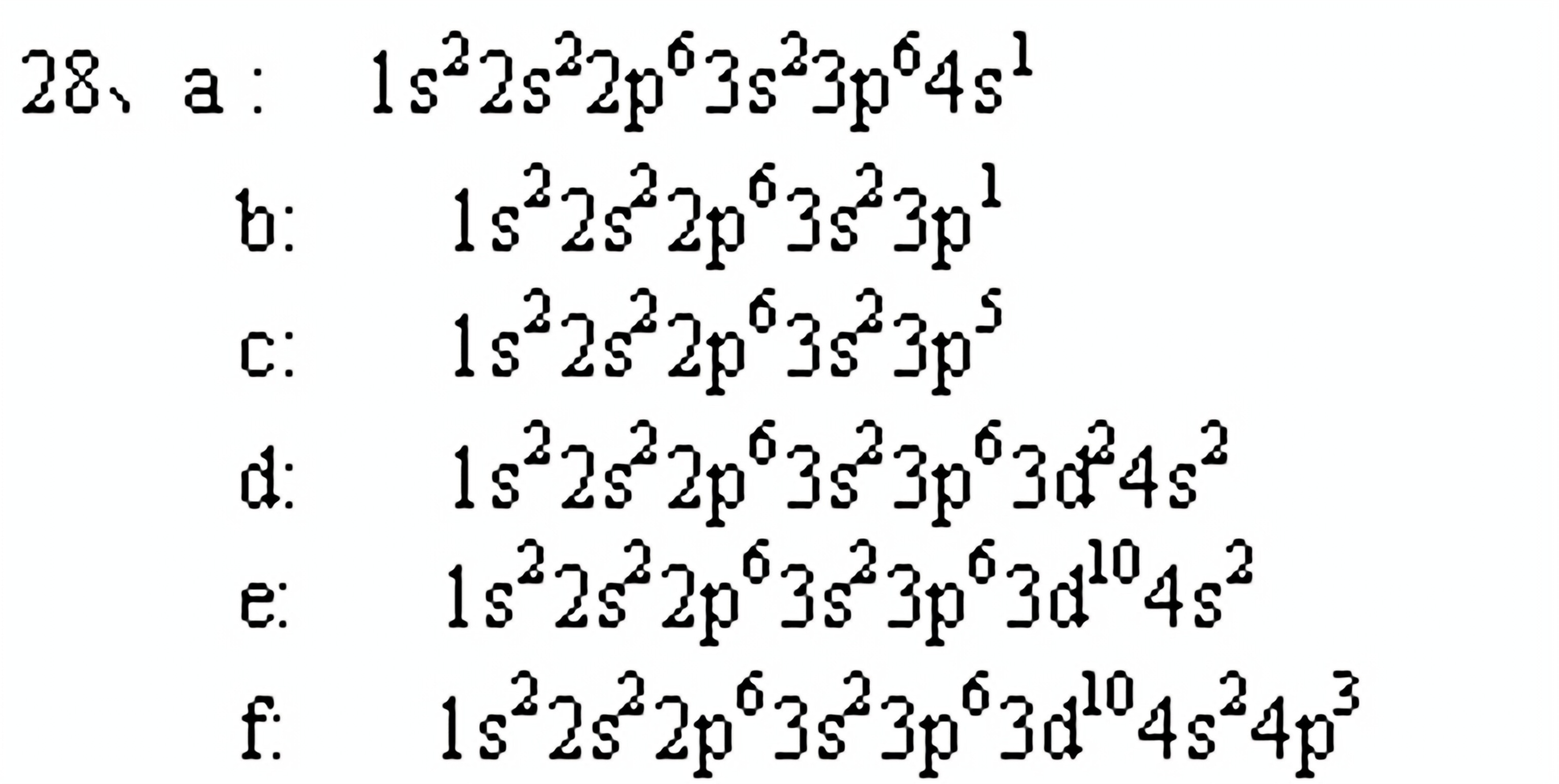
1-29 若构造原理对新合成的及未合成的人造元素仍有效,请预言第118和166号元素在周期表中的位置(注:1999年美国宣布合成了118 号元素及其衰变产物116号元素,但2001年因不能重复而收回该报道)。

Be
N
F
Cl-
Ne+
Fe3+
As3+
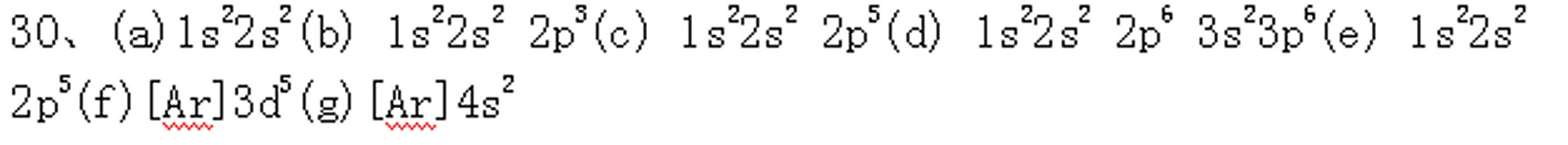
1-31 下列哪些组态符合洪特规则?
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↓↓
↑↓ ↑↓ ↑ ↑ ↑
↑↓ ↑↓ ↑↓ ↑↓↑↓ ↑↑↑↑

1-32 以下哪些原子或离子的电子组态是基态﹑激发态还是不可能的组态?
1s22s2
1s23s1
1s23d3 (d)[Ne]3s23d1 (e)[Ar]3d24s2 (f)1s22s22p63s1 (g)[Ne]3s23d12 (f)[Xe]4f7 ( g)[Ar]3d6

Li+ ﹑Na+﹑K+ ﹑Rb+﹑Cs+ 的基态的最外层电子组态与次外层电子组态分别如何?

l3+ , Ga3+,
i3+, Mn3+, Se3+

1-35已知电中性的基态原子的价电子层电子组态分别为:
3s23p5(b)3d64s2(c)5s2(d)4f96s2(e)5d106s1
Jensen 合成了一种配合物,化学式为 Ni[P(C2H5)3]3Br ,该化合物呈顺磁性,有极性,但难溶于水而易溶于苯,其苯溶液不导电。试画出这种配合物的所有可能结构,若有对映异构体需标明对映关系。
9-24以下说法对不对?简述理由。
e3+ 的颜色
e(CNS)n3-n 的n越大,离子的颜色越深。
(3)配合物中配体的数目称为配位数。
(4)配位化合物的中心原子的氧化态不可能等于零,更不可能为负值。
O 是用氧原子和中心原子结合的,因为氧的电负性比碳大。
(6)同一种金属元素的配合物的磁性决定于该元素的氧化态,氧化态越高,磁矩就越大。
o(en)33-没有立体异构体。
Ti(CN)63- 的颜色比TiCl63- 的颜色深。
Ni2+ 的六配位八面体配合物按磁矩的大小可分为高自旋和低自旋两种。
(10)晶体场稳定化能为零的配合物是不稳定的。
CD-Chemsketch 制作穴醚 N(CH2CH2OCH2CH2OCH2CH2)3 N的三维,用该程序优化后计算该配体的内径大小,再查出碱金属离子的半径,估计该穴醚能否容纳碱金属离子。
9-26 4-23是晶体场理论中平面四配位(右)跟八面体配位(左)的d轨道分裂对比。
(1)设平面结构的四个配体是以x和y轴的方向向中心原子靠拢的,试定性地说明为什么八面体结构中的dr 轨道组在平面四配位结构中会分为两组?并给出后者能量最高的d轨道的符号。
(2)定性地说明八面体结构中的 d∈ 轨道组在平面四边形结构中也会变为两组,并给出后者能量最低的d轨道的符号。
N)42-的磁矩,并与价键轨道理论的估计相对比。
(4)实验证实镍的所有平面四边形配合物都是低自旋的,从上应如何释该事实?
9-27实验测得一些配合物的磁矩如下,由该实验事实预言这些配合物中心原子的未成对电子数﹑ 杂化轨道类型﹑ 配合物的空间结构类型﹑属价键理论的内轨型还是外轨型﹑ 属晶体场理论的高自旋还是低自旋?
[Fe(en)3]2+ 5.5 B M [Co(SCN)4] 2- 4.3 B M [Mn(CN)4] 2- 1.8 B M
[FeF6] 3- 5.9 B M [Ni(CN)4] 2- 0 B M [Ni(NH3)6] 2+ 3.2 B M
题目解答
答案
(a)K (b)Al (c)Cl (d)Ti(Z=22) (e)Zn(Z=30) (f)As(Z=33) word/media/image31.png 1-29 若构造原理对新合成的及未合成的人造元素仍有效,请预言第118和166号元素在周期表中的位置(注:1999年美国宣布合成了118 号元素及其衰变产物116号元素,但2001年因不能重复而收回该报道)。 word/media/image32.png 1-30 给出下列基态原子或离子的价电子层电子组态,并用方框表示轨道,填入轨道的电子则用箭头表示。(a)Be (b)N (c)F (d)Cl - (e)Ne + (f)Fe 3+ (g)As 3+ word/media/image33.png 1-31 下列哪些组态符合洪特规则? 1s 2s 2p 3s 3p ↑↓ ↑↓ ↑↓ ↓↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑↓ ↑↓ ↑↓ ↑↓↑↓ ↑↑↑↑ word/media/image34.png word/media/image35.png 1-32 以下哪些原子或离子的电子组态是基态﹑激发态还是不可能的组态? (a ) 1s 2 2s 2 (b ) 1s 2 3s 1 (c ) 1s 2 3d 3 (d ) [Ne]3s 2 3d 1 (e ) [Ar]3d 2 4s 2 (f ) 1s 2 2s 2 2p 6 3s 1 (g ) [Ne]3s 2 3d 12 (f ) [Xe]4f 7 ( g ) [Ar]3d 6 word/media/image36.png 1-33 Li + ﹑Na + ﹑ K + ﹑ Rb + ﹑ Cs + 的基态的最外层电子组态与次外层电子组态分别如何? word/media/image37.png 1-34 以下+3价离子哪些具有8电子外壳?Al 3+ , Ga 3+ , Bi 3+ , Mn 3+ , Se 3+ word/media/image38.png 1-35已知电中性的基态原子的价电子层电子组态分别为: 3s 2 3p 5 (b ) 3d 6 4s 2 (c ) 5s 2 (d ) 4f 9 6s 2 (e ) 5d 10 6s 1 9-231986年Jensen 合成了一种配合物,化学式为 Ni[P(C 2 H 5 ) 3 ] 3 Br ,该化合物呈顺磁性,有极性,但难溶于水而易溶于苯,其苯溶液不导电。试画出这种配合物的所有可能结构,若有对映异构体需标明对映关系。 9-24以下说法对不对?简述理由。 (1)粗盐酸的黄色时Fe 3+ 的颜色 (2)根据光化学序列可断言,Fe(CNS)n 3-n 的n越大,离子的颜色越深。 (3)配合物中配体的数目称为配位数。 (4)配位化合物的中心原子的氧化态不可能等于零,更不可能为负值。 (5)羟基化合物中的配体 CO 是用氧原子和中心原子结合的,因为氧的电负性比碳大。 (6)同一种金属元素的配合物的磁性决定于该元素的氧化态,氧化态越高,磁矩就越大。 Co(en) 3 3- 没有立体异构体。 (8)根据晶体场理论可以预言,Ti(CN) 6 3- 的颜色比TiCl 6 3- 的颜色深。 (9)根据晶体场理论,Ni 2+ 的六配位八面体配合物按磁矩的大小可分为高自旋和低自旋两种。 (10)晶体场稳定化能为零的配合物是不稳定的。 9-25 用免费做程序ACD-Chemsketch 制作穴醚 N(CH 2 CH 2 OCH 2 CH 2 OCH 2 CH 2 ) 3 N的三维,用该程序优化后计算该配体的内径大小,再查出碱金属离子的半径,估计该穴醚能否容纳碱金属离子。 9-26 4-23是晶体场理论中平面四配位(右)跟八面体配位(左)的d轨道分裂对比。 (1)设平面结构的四个配体是以x和y轴的方向向中心原子靠拢的,试定性地说明为什么八面体结构中的d r 轨道组在平面四配位结构中会分为两组?并给出后者能量最高的d 轨道的符号。 (2)定性地说明八面体结构中的 d ∈ 轨道组在平面四边形结构中也会变为两组,并给出后者能量最低的d轨道的符号。 (3)按上估计配合物 Ni(CN) 4 2- 的磁矩,并与价键轨道理论的估计相对比。 (4)实验证实镍的所有平面四边形配合物都是低自旋的,从上应如何释该事实? 9-27实验测得一些配合物的磁矩如下,由该实验事实预言这些配合物中心原子的未成对电子数﹑ 杂化轨道类型﹑ 配合物的空间结构类型﹑属价键理论的内轨型还是外轨型﹑ 属晶体场理论的高自旋还是低自旋? [Fe(en) 3 ] 2+ 5.5 B M [Co(SCN) 4 ] 2- 4.3 B M [Mn(CN) 4 ] 2- 1.8 B M [FeF 6 ] 3- 5.9 B M [Ni(CN) 4 ] 2- 0 B M [Ni(NH 3 ) 6 ] 2+ 3.2 B M