题目
氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等。回答下列问题:(1)基态氟原子中有 ____ 种能量不同的电子。(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3(-33℃)的沸点比NF3(-129℃)的高,原因为 ____ 。(3)氟硼酸(HBF4属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因: ____ 。(4)液态[H2F]+中存在[H2F]+和[HF2)]-,[HF2]-的结构可表示为[P-H…F]-,[H2F]+的VSEPR模型名称为 ____ 形。NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解。NaHF2中所含作用力的类型有 ____ (填字母)。a.离子键 b.共价键 c.配位键 d.氢键(5)CaF2是难溶化合物,其晶胞结构如图所示:C-|||-点 D-|||-C 。-|||-a f-|||-ò。 Ca^2-|||-A-|||-B-|||--|||--|||-0 x①若原子坐标参数A处为(0,0,0),B处为((1)/(2),(1)/(2),0),C处为(1.1,1),则D处为 ____ 。②每个Ca2+周围距离最近的Ca2+共有 ____ 个。③已知:CaF2晶体密度为c g•cm3则晶胞中Ca2+与最近的F之间的距离为 ____ nm (设NA表示阿伏加德罗常数的值,用含c、NA的式子表示)。
氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等。回答下列问题:
(1)基态氟原子中有 ____ 种能量不同的电子。
(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3(-33℃)的沸点比NF3(-129℃)的高,原因为 ____ 。
(3)氟硼酸(HBF4属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因: ____ 。
(4)液态[H2F]+中存在[H2F]+和[HF2)]-,[HF2]-的结构可表示为[P-H…F]-,[H2F]+的VSEPR模型名称为 ____ 形。NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解。NaHF2中所含作用力的类型有 ____ (填字母)。
a.离子键 b.共价键 c.配位键 d.氢键
(5)CaF2是难溶化合物,其晶胞结构如图所示: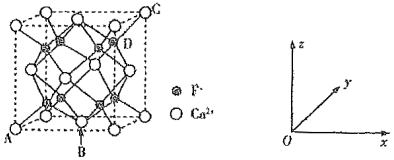
①若原子坐标参数A处为(0,0,0),B处为($\frac{1}{2}$,$\frac{1}{2}$,0),C处为(1.1,1),则D处为 ____ 。
②每个Ca2+周围距离最近的Ca2+共有 ____ 个。
③已知:CaF2晶体密度为c g•cm3则晶胞中Ca2+与最近的F之间的距离为 ____ nm (设NA表示阿伏加德罗常数的值,用含c、NA的式子表示)。
(1)基态氟原子中有 ____ 种能量不同的电子。
(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3(-33℃)的沸点比NF3(-129℃)的高,原因为 ____ 。
(3)氟硼酸(HBF4属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因: ____ 。
(4)液态[H2F]+中存在[H2F]+和[HF2)]-,[HF2]-的结构可表示为[P-H…F]-,[H2F]+的VSEPR模型名称为 ____ 形。NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解。NaHF2中所含作用力的类型有 ____ (填字母)。
a.离子键 b.共价键 c.配位键 d.氢键
(5)CaF2是难溶化合物,其晶胞结构如图所示:

①若原子坐标参数A处为(0,0,0),B处为($\frac{1}{2}$,$\frac{1}{2}$,0),C处为(1.1,1),则D处为 ____ 。
②每个Ca2+周围距离最近的Ca2+共有 ____ 个。
③已知:CaF2晶体密度为c g•cm3则晶胞中Ca2+与最近的F之间的距离为 ____ nm (设NA表示阿伏加德罗常数的值,用含c、NA的式子表示)。
题目解答
答案
解:(1)F原子核外电子排布式为1s22s22p5,有1s、2s、2p3个能级,故基态氟原子中有 3种能量不同的电子,
故答案为:3;
(2)NF3与NH3的空间构型相同,但是NH3(-33℃)的沸点比NF3(-129℃)的高,原因为:二者均为分子晶体,但NH3分子间能形成氢键,
故答案为:二者均为分子晶体,但NH3分子间能形成氢键;
(3)含有空轨道和含有孤电子对的原子之间易形成配位键,BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键,所以HF能和氟化硼反应生成HBF4,
故答案为:HF分子中F原子有孤对电子对,而BF3分子中B原子有空轨道,二者可以形成配位键;
(4)[H2F]+的价电子对数=2+$\frac{1}{2}$(7-2-1)=4,VSEPR模型名称为四面体,NaHF2为离子化合物,存在离子键,H-F键为共价键,F的电负性较强,还存在氢键,故选:abd;
故答案为:四面体;abd;
(5)①CaF2的晶胞,其中原子坐标参数A处为 (0,0,0);B处为($\frac{1}{2}$,$\frac{1}{2}$,0);C处为(1,1,1),则D处微粒在x、y、z轴上的投影分别是$\frac{3}{4}$、$\frac{3}{4}$、$\frac{3}{4}$,所以其晶胞参数为($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$),
故答案为:($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$);
②每个Ca2+周围距离最近的Ca2+是顶角和面心的钙离子共计12个,
故答案为:12;
③该晶胞中氟离子个数=8、钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞体积=$\frac{\frac{4}{{N}_{A}}×M}{ρ}$,晶胞棱长=$\root{3}{\frac{4M}{ρ{N}_{A}}}$,晶胞中Ca2+与离它最近的F-之间的距离为晶胞体对角线的$\frac{1}{4}$,$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{4M}{ρ{N}_{A}}}$=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{c×{N}_{A}}}$×107nm,
故答案为:($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$);12;$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{c×{N}_{A}}}$×107。
故答案为:3;
(2)NF3与NH3的空间构型相同,但是NH3(-33℃)的沸点比NF3(-129℃)的高,原因为:二者均为分子晶体,但NH3分子间能形成氢键,
故答案为:二者均为分子晶体,但NH3分子间能形成氢键;
(3)含有空轨道和含有孤电子对的原子之间易形成配位键,BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键,所以HF能和氟化硼反应生成HBF4,
故答案为:HF分子中F原子有孤对电子对,而BF3分子中B原子有空轨道,二者可以形成配位键;
(4)[H2F]+的价电子对数=2+$\frac{1}{2}$(7-2-1)=4,VSEPR模型名称为四面体,NaHF2为离子化合物,存在离子键,H-F键为共价键,F的电负性较强,还存在氢键,故选:abd;
故答案为:四面体;abd;
(5)①CaF2的晶胞,其中原子坐标参数A处为 (0,0,0);B处为($\frac{1}{2}$,$\frac{1}{2}$,0);C处为(1,1,1),则D处微粒在x、y、z轴上的投影分别是$\frac{3}{4}$、$\frac{3}{4}$、$\frac{3}{4}$,所以其晶胞参数为($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$),
故答案为:($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$);
②每个Ca2+周围距离最近的Ca2+是顶角和面心的钙离子共计12个,
故答案为:12;
③该晶胞中氟离子个数=8、钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞体积=$\frac{\frac{4}{{N}_{A}}×M}{ρ}$,晶胞棱长=$\root{3}{\frac{4M}{ρ{N}_{A}}}$,晶胞中Ca2+与离它最近的F-之间的距离为晶胞体对角线的$\frac{1}{4}$,$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{4M}{ρ{N}_{A}}}$=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{c×{N}_{A}}}$×107nm,
故答案为:($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$);12;$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{c×{N}_{A}}}$×107。