题目
8-2 在总压 =500kN/(m)^2 温度 =(27)^circ C 下使含CO23.0%(体积分数)的气体与含 (O)_(2)370g/(m)^3 的水相-|||-接触。在操作条件下,亨利系数 =1.73times (10)^5k(N)^2, 水溶液的密度可取 /(m)^3, CO2的相对-|||-分子质量为44。试判断是发生吸收还是解吸?并计算以CO2的分压差表示的总传质推动力。

题目解答
答案
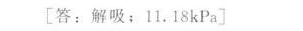
解析
步骤 1:计算气体中CO2的分压
根据题意,气体中CO2的体积分数为3.0%,总压为500 kPa。因此,气体中CO2的分压为:
\[ p_{CO2} = 0.03 \times 500 kPa = 15 kPa \]
步骤 2:计算水溶液中CO2的浓度
根据题意,水溶液中CO2的浓度为370 g/m³,水溶液的密度为1000 kg/m³,CO2的相对分子质量为44。因此,水溶液中CO2的摩尔浓度为:
\[ c_{CO2} = \frac{370 g/m^3}{44 g/mol} = 8.41 mol/m^3 \]
步骤 3:计算水溶液中CO2的平衡分压
根据亨利定律,水溶液中CO2的平衡分压为:
\[ p_{CO2}^{*} = E \times c_{CO2} = 1.73 \times 10^5 kPa \times 8.41 mol/m^3 = 145.3 kPa \]
步骤 4:判断是发生吸收还是解吸
由于水溶液中CO2的平衡分压(145.3 kPa)大于气体中CO2的分压(15 kPa),因此是发生解吸。
步骤 5:计算以CO2的分压差表示的总传质推动力
总传质推动力为:
\[ \Delta p_{CO2} = p_{CO2}^{*} - p_{CO2} = 145.3 kPa - 15 kPa = 130.3 kPa \]
根据题意,气体中CO2的体积分数为3.0%,总压为500 kPa。因此,气体中CO2的分压为:
\[ p_{CO2} = 0.03 \times 500 kPa = 15 kPa \]
步骤 2:计算水溶液中CO2的浓度
根据题意,水溶液中CO2的浓度为370 g/m³,水溶液的密度为1000 kg/m³,CO2的相对分子质量为44。因此,水溶液中CO2的摩尔浓度为:
\[ c_{CO2} = \frac{370 g/m^3}{44 g/mol} = 8.41 mol/m^3 \]
步骤 3:计算水溶液中CO2的平衡分压
根据亨利定律,水溶液中CO2的平衡分压为:
\[ p_{CO2}^{*} = E \times c_{CO2} = 1.73 \times 10^5 kPa \times 8.41 mol/m^3 = 145.3 kPa \]
步骤 4:判断是发生吸收还是解吸
由于水溶液中CO2的平衡分压(145.3 kPa)大于气体中CO2的分压(15 kPa),因此是发生解吸。
步骤 5:计算以CO2的分压差表示的总传质推动力
总传质推动力为:
\[ \Delta p_{CO2} = p_{CO2}^{*} - p_{CO2} = 145.3 kPa - 15 kPa = 130.3 kPa \]