题目
一、 =dfrac (N)({N)_(A)}=dfrac (m)(M)=dfrac (V)({V)_(m)} 关系的应用-|||-1.(1)标准状况下,4.8 g甲烷(CH4)所占的体-|||-积为 __ L,它与标准状况下 __-|||-L硫化氢(H2S )含有相同数目的氢原子。-|||-(2)标准状况下,16g O2与14gN2的混合气-|||-体所占的体积是 __ 。-|||-(3) .03times (10)^23 个NH3含有 __ mol氢-|||-原子, __ mol质子,在标准状况下的体-|||-积约为 __ L。-|||-(4)标准状况下,若6.72 LO3含有m个氧原-|||-子,则阿伏加德罗常数的值可表示为 __-|||-__ (用含m的式子表示)。

题目解答
答案
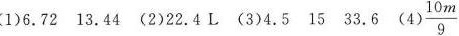
解析
步骤 1:计算甲烷的摩尔数
甲烷的摩尔质量为16 g/mol,4.8 g甲烷的摩尔数为 $\dfrac{4.8}{16} = 0.3$ mol。
步骤 2:计算甲烷的体积
标准状况下,1 mol气体的体积为22.4 L,因此0.3 mol甲烷的体积为 $0.3 \times 22.4 = 6.72$ L。
步骤 3:计算硫化氢的体积
甲烷和硫化氢中氢原子数相同,即0.3 mol甲烷含1.2 mol氢原子,硫化氢中氢原子数为2,因此硫化氢的摩尔数为0.6 mol,体积为 $0.6 \times 22.4 = 13.44$ L。
步骤 4:计算混合气体的体积
16 g O2的摩尔数为 $\dfrac{16}{32} = 0.5$ mol,14 g N2的摩尔数为 $\dfrac{14}{28} = 0.5$ mol,混合气体的摩尔数为1 mol,体积为22.4 L。
步骤 5:计算氨气的摩尔数和体积
$9.03 \times 10^{23}$ 个NH3的摩尔数为 $\dfrac{9.03 \times 10^{23}}{6.02 \times 10^{23}} = 1.5$ mol,含氢原子数为4.5 mol,质子数为15 mol,体积为 $1.5 \times 22.4 = 33.6$ L。
步骤 6:计算阿伏加德罗常数
6.72 L O3的摩尔数为 $\dfrac{6.72}{22.4} = 0.3$ mol,含氧原子数为0.9 mol,即0.9 mol氧原子数为m个,因此阿伏加德罗常数为 $\dfrac{m}{0.9} = \dfrac{10m}{9}$。
甲烷的摩尔质量为16 g/mol,4.8 g甲烷的摩尔数为 $\dfrac{4.8}{16} = 0.3$ mol。
步骤 2:计算甲烷的体积
标准状况下,1 mol气体的体积为22.4 L,因此0.3 mol甲烷的体积为 $0.3 \times 22.4 = 6.72$ L。
步骤 3:计算硫化氢的体积
甲烷和硫化氢中氢原子数相同,即0.3 mol甲烷含1.2 mol氢原子,硫化氢中氢原子数为2,因此硫化氢的摩尔数为0.6 mol,体积为 $0.6 \times 22.4 = 13.44$ L。
步骤 4:计算混合气体的体积
16 g O2的摩尔数为 $\dfrac{16}{32} = 0.5$ mol,14 g N2的摩尔数为 $\dfrac{14}{28} = 0.5$ mol,混合气体的摩尔数为1 mol,体积为22.4 L。
步骤 5:计算氨气的摩尔数和体积
$9.03 \times 10^{23}$ 个NH3的摩尔数为 $\dfrac{9.03 \times 10^{23}}{6.02 \times 10^{23}} = 1.5$ mol,含氢原子数为4.5 mol,质子数为15 mol,体积为 $1.5 \times 22.4 = 33.6$ L。
步骤 6:计算阿伏加德罗常数
6.72 L O3的摩尔数为 $\dfrac{6.72}{22.4} = 0.3$ mol,含氧原子数为0.9 mol,即0.9 mol氧原子数为m个,因此阿伏加德罗常数为 $\dfrac{m}{0.9} = \dfrac{10m}{9}$。