题目
二氧化氯(ClO2)具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过SO2与酸性NaClO3溶液反应制备。某化学兴趣小组同学设计了如图装置制备ClO2并探究其性质。浓硫酸-|||-a b c d e f g h-|||-Na2SO3 NaClO3 aOH-|||-固体 H2SO4 溶液 冰水-|||-A B C D E已知:浓硫酸与Na2SO3固体反应可用来制备SO2,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成SO42-。回答下列问题:(1)A中盛装Na2SO3固体的仪器名称为 ____ 。(2)通过装置B中反应制备ClO2,氧化剂和还原剂的物质的量之比为 ____ 。(3)欲制备一瓶ClO2,选择图中的装置,其接口的连接顺序为a-g-h- ____ 。(4)装置D盛放冰水的目的 ____ 。(5)证明ClO2的氧化性比Fe3+强的实验方案是 ____ 。(6)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力(还原产物均为氯离子)。ClO2的有效氯含量为 ____ 克。(计算结果保留一位小数)
二氧化氯(ClO2)具有强氧化性,是一种常用的消毒剂。它是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,可通过SO2与酸性NaClO3溶液反应制备。某化学兴趣小组同学设计了如图装置制备ClO2并探究其性质。
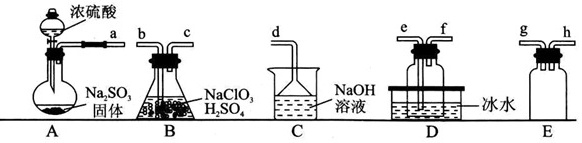
已知:浓硫酸与Na2SO3固体反应可用来制备SO2,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成SO42-。回答下列问题:
(1)A中盛装Na2SO3固体的仪器名称为 ____ 。
(2)通过装置B中反应制备ClO2,氧化剂和还原剂的物质的量之比为 ____ 。
(3)欲制备一瓶ClO2,选择图中的装置,其接口的连接顺序为a-g-h- ____ 。
(4)装置D盛放冰水的目的 ____ 。
(5)证明ClO2的氧化性比Fe3+强的实验方案是 ____ 。
(6)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力(还原产物均为氯离子)。ClO2的有效氯含量为 ____ 克。(计算结果保留一位小数)

已知:浓硫酸与Na2SO3固体反应可用来制备SO2,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成SO42-。回答下列问题:
(1)A中盛装Na2SO3固体的仪器名称为 ____ 。
(2)通过装置B中反应制备ClO2,氧化剂和还原剂的物质的量之比为 ____ 。
(3)欲制备一瓶ClO2,选择图中的装置,其接口的连接顺序为a-g-h- ____ 。
(4)装置D盛放冰水的目的 ____ 。
(5)证明ClO2的氧化性比Fe3+强的实验方案是 ____ 。
(6)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力(还原产物均为氯离子)。ClO2的有效氯含量为 ____ 克。(计算结果保留一位小数)
题目解答
答案
解:(1)A中盛装Na2SO3固体的仪器名称为圆底烧瓶,
故答案为:圆底烧瓶;
(2)由SO2+2NaClO3=2ClO2↑+Na2SO4可知,二氧化硫是还原剂,氯酸钾是氧化剂,所以氧化剂与还原剂的物质的量的比为2:1,
故答案为:2:1;
(3)最左侧应为二氧化硫制取的发生装置,二氧化硫要通入氯酸钠溶液中,由于二氧化硫在水中的溶解度较大,所以要加安全瓶防止倒吸,然后通入溶液中,再收集产物,长管进、短管出,最有吸收尾气,所以顺序应为a-g-h-b-c-e-f-d,
故答案为:b-c-e-f-d;
(4)结合题干可知,ClO2的沸点为11℃,所以装置D盛放冰水的目的是冷凝收集ClO2,
故答案为:冷凝收集ClO2;
(5)若ClO2的氧化性比Fe2+强,则二者可以发生反应生成Fe3+,再加入KSCN,观察颜色会发生变化,证明ClO2的氧化性比Fe3+强的实验方案是将ClO2气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化,
故答案为:将ClO2气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化;
(6)二氧化氯中氯的还原产物为Cl-,所以共转移电子的物质的量n=$\frac{1}{67.5}$mol×5≈0.074mol,氯气中Cl元素的化合价有0价降低到-1价,设转移0.074mol电子需要氯气xg,所以应该有$\frac{x}{71}$×2=0.074,解得x=2.6,
故答案为:2.6。
故答案为:圆底烧瓶;
(2)由SO2+2NaClO3=2ClO2↑+Na2SO4可知,二氧化硫是还原剂,氯酸钾是氧化剂,所以氧化剂与还原剂的物质的量的比为2:1,
故答案为:2:1;
(3)最左侧应为二氧化硫制取的发生装置,二氧化硫要通入氯酸钠溶液中,由于二氧化硫在水中的溶解度较大,所以要加安全瓶防止倒吸,然后通入溶液中,再收集产物,长管进、短管出,最有吸收尾气,所以顺序应为a-g-h-b-c-e-f-d,
故答案为:b-c-e-f-d;
(4)结合题干可知,ClO2的沸点为11℃,所以装置D盛放冰水的目的是冷凝收集ClO2,
故答案为:冷凝收集ClO2;
(5)若ClO2的氧化性比Fe2+强,则二者可以发生反应生成Fe3+,再加入KSCN,观察颜色会发生变化,证明ClO2的氧化性比Fe3+强的实验方案是将ClO2气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化,
故答案为:将ClO2气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化;
(6)二氧化氯中氯的还原产物为Cl-,所以共转移电子的物质的量n=$\frac{1}{67.5}$mol×5≈0.074mol,氯气中Cl元素的化合价有0价降低到-1价,设转移0.074mol电子需要氯气xg,所以应该有$\frac{x}{71}$×2=0.074,解得x=2.6,
故答案为:2.6。
解析
(1)步骤 1:仪器名称
A中盛装Na_2SO_3固体的仪器名称为圆底烧瓶。
(2)步骤 2:氧化剂和还原剂的物质的量之比
由SO_2+2NaClO_3=2ClO_2↑+Na_2SO_4可知,二氧化硫是还原剂,氯酸钾是氧化剂,所以氧化剂与还原剂的物质的量的比为2:1。
(3)步骤 3:接口的连接顺序
最左侧应为二氧化硫制取的发生装置,二氧化硫要通入氯酸钠溶液中,由于二氧化硫在水中的溶解度较大,所以要加安全瓶防止倒吸,然后通入溶液中,再收集产物,长管进、短管出,最有吸收尾气,所以顺序应为a-g-h-b-c-e-f-d。
(4)步骤 4:装置D盛放冰水的目的
结合题干可知,ClO_2的沸点为11℃,所以装置D盛放冰水的目的是冷凝收集ClO_2。
(5)步骤 5:证明ClO_2的氧化性比Fe^{3+}强的实验方案
若ClO_2的氧化性比Fe^{2+}强,则二者可以发生反应生成Fe^{3+},再加入KSCN,观察颜色会发生变化,证明ClO_2的氧化性比Fe^{3+}强的实验方案是将ClO_2气体通入FeSO_4溶液中,并滴入KSCN溶液,观察溶液颜色变化。
(6)步骤 6:ClO_2的有效氯含量
二氧化氯中氯的还原产物为Cl^{-},所以共转移电子的物质的量n=$\frac{1}{67.5}$mol×5≈0.074mol,氯气中Cl元素的化合价有0价降低到-1价,设转移0.074mol电子需要氯气xg,所以应该有$\frac{x}{71}$×2=0.074,解得x=2.6。
A中盛装Na_2SO_3固体的仪器名称为圆底烧瓶。
(2)步骤 2:氧化剂和还原剂的物质的量之比
由SO_2+2NaClO_3=2ClO_2↑+Na_2SO_4可知,二氧化硫是还原剂,氯酸钾是氧化剂,所以氧化剂与还原剂的物质的量的比为2:1。
(3)步骤 3:接口的连接顺序
最左侧应为二氧化硫制取的发生装置,二氧化硫要通入氯酸钠溶液中,由于二氧化硫在水中的溶解度较大,所以要加安全瓶防止倒吸,然后通入溶液中,再收集产物,长管进、短管出,最有吸收尾气,所以顺序应为a-g-h-b-c-e-f-d。
(4)步骤 4:装置D盛放冰水的目的
结合题干可知,ClO_2的沸点为11℃,所以装置D盛放冰水的目的是冷凝收集ClO_2。
(5)步骤 5:证明ClO_2的氧化性比Fe^{3+}强的实验方案
若ClO_2的氧化性比Fe^{2+}强,则二者可以发生反应生成Fe^{3+},再加入KSCN,观察颜色会发生变化,证明ClO_2的氧化性比Fe^{3+}强的实验方案是将ClO_2气体通入FeSO_4溶液中,并滴入KSCN溶液,观察溶液颜色变化。
(6)步骤 6:ClO_2的有效氯含量
二氧化氯中氯的还原产物为Cl^{-},所以共转移电子的物质的量n=$\frac{1}{67.5}$mol×5≈0.074mol,氯气中Cl元素的化合价有0价降低到-1价,设转移0.074mol电子需要氯气xg,所以应该有$\frac{x}{71}$×2=0.074,解得x=2.6。