题目
2.303是哪来的15.已知反应:-|||-dfrac (1)(2)(H)_(2)(g)+dfrac (1)(2)(Cl)_(2)(g)leftharpoons HCl(g)-|||-在298.15K时的 _(1)^theta =4.9times (10)^16, _(m)(H)_(m)^theta (298.15K)=-92.31kJcdot (mol)^-1, 求在500K时的K2。
2.303是哪来的
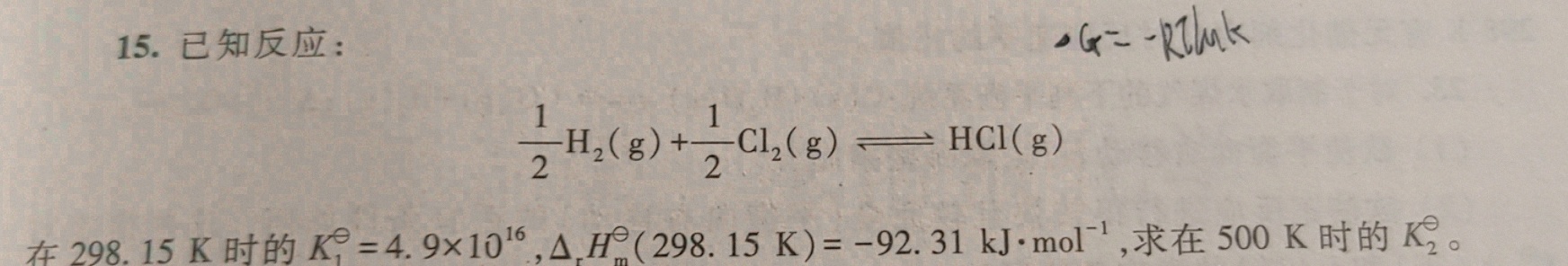
题目解答
答案

解析
考查要点:本题主要考查范特霍夫方程的应用,即利用化学反应的焓变(ΔH)和温度变化来计算平衡常数的变化。
解题核心思路:
- 范特霍夫方程是联系平衡常数与温度的桥梁,其积分形式为:
$\ln \frac{K_2}{K_1} = -\frac{\Delta H_m^\theta}{R} \left( \frac{1}{T_2} - \frac{1}{T_1} \right)$
其中,$\Delta H_m^\theta$为反应的焓变,$R$为气体常数,$T_1$和$T_2$分别为初始温度和目标温度。 - 关键点在于正确代入已知数据,注意单位统一(ΔH需转换为焦耳)和符号处理(放热反应ΔH为负)。
破题关键:
- 明确反应为放热(ΔH为负),温度升高时平衡常数应减小,验证计算结果的合理性。
步骤1:写出范特霍夫方程
根据范特霍夫方程:
$\ln \frac{K_2}{K_1} = -\frac{\Delta H_m^\theta}{R} \left( \frac{1}{T_2} - \frac{1}{T_1} \right)$
步骤2:代入已知数据
- $\Delta H_m^\theta = -92.31 \, \text{kJ/mol} = -92310 \, \text{J/mol}$
- $R = 8.314 \, \text{J/mol·K}$
- $T_1 = 298.15 \, \text{K}$,$T_2 = 500 \, \text{K}$
- $K_1 = 4.9 \times 10^{16}$
计算右侧表达式:
$\begin{aligned}-\frac{\Delta H_m^\theta}{R} \left( \frac{1}{T_2} - \frac{1}{T_1} \right) &= -\frac{-92310}{8.314} \left( \frac{1}{500} - \frac{1}{298.15} \right) \\&= 11103.3 \times (-0.001355) \\&= -15.06\end{aligned}$
步骤3:求解$K_2$
由$\ln \frac{K_2}{K_1} = -15.06$,得:
$\frac{K_2}{K_1} = e^{-15.06} \approx 2.88 \times 10^{-7}$
因此:
$K_2 = K_1 \times 2.88 \times 10^{-7} = 4.9 \times 10^{16} \times 2.88 \times 10^{-7} \approx 1.41 \times 10^{10}$