题目
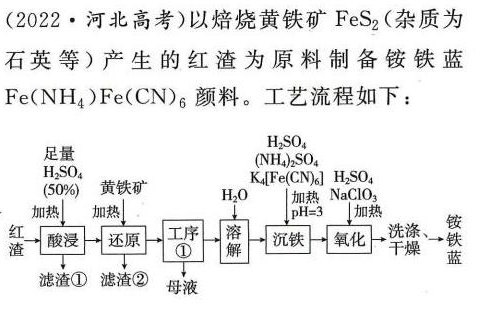
(2022·河北高考)以焙烧黄铁矿FeS 2(杂质为-|||-石英等)产生的红渣为原料制备铵铁蓝-|||-Fe(NH4)Fe(CN)6颜料。工艺流程如下:-|||-足量 (NH4)2SO4-|||-H2SO4-|||-H2SO4 K4[Fe(CN)6] H2SO4-|||-50%) 黄铁矿 H2O 加热 NaClO3-|||-加热 加热 =3 加热 铵-|||-红 洗涤-|||-渣 酸浸 还原 工序 溶 沉铁 氧化 干燥 → 铁-|||-① 解 蓝-|||-滤渣① 滤渣② 母液(2022·河北高考)以焙烧黄铁矿FeS 2(杂质为-|||-石英等)产生的红渣为原料制备铵铁蓝-|||-Fe(NH4)Fe(CN)6颜料。工艺流程如下:-|||-足量 (NH4)2SO4-|||-H2SO4-|||-H2SO4 K4[Fe(CN)6] H2SO4-|||-50%) 黄铁矿 H2O 加热 NaClO3-|||-加热 加热 =3 加热 铵-|||-红 洗涤-|||-渣 酸浸 还原 工序 溶 沉铁 氧化 干燥 → 铁-|||-① 解 蓝-|||-滤渣① 滤渣② 母液

题目解答
答案
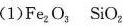

解析
- 考查要点:本题主要考查工艺流程中的物质变化、化学反应方程式的书写、离子方程式的分析、物质分离与提纯方法、化合价计算及试剂选择等知识点。
- 解题核心:
- 流程分析:通过工艺流程图明确各步骤的化学反应及目标产物。
- 物质性质:利用Fe的氧化物、硫化物、配合物的性质分析反应条件。
- 守恒与配平:根据原子守恒、电荷守恒配平化学方程式和离子方程式。
- 破题关键:
- 红渣成分:黄铁矿(FeS₂)焙烧生成Fe₂O₃和SO₂,杂质SiO₂不参与反应。
- 研磨作用:增大接触面积,加快反应速率。
- 氧化还原反应:Fe³⁺被FeS₂还原为Fe²⁺,ClO₃⁻氧化Fe²⁺为Fe³⁺。
- 母液循环:蒸发浓缩、冷却结晶析出晶体。
(1) 红渣的主要成分与滤渣①的成分
- 红渣:黄铁矿(FeS₂)焙烧生成Fe₂O₃,杂质SiO₂不反应,故主要成分为 Fe₂O₃ 和 SiO₂。
- 滤渣①:酸浸后未溶解的SiO₂残留,故为 SiO₂。
(2) 黄铁矿研细的目的
- 增大接触面积,加快反应速率,提高黄铁矿利用率。
(3) 还原工序的化学方程式
- Fe³⁺被FeS₂还原为Fe²⁺,反应为:
$7\text{Fe}_2(\text{SO}_4)_3 + \text{FeS}_2 + 8\text{H}_2\text{O} \rightarrow 15\text{FeSO}_4 + 8\text{H}_2\text{SO}_4$
(4) 工序①的名称
- 母液循环需通过 蒸发浓缩、冷却结晶、过滤、洗涤 得到晶体。
(5) 白色沉淀中铁的化合价与氧化反应
- Fe的化合价:Fe(NH₄)Fe(CN)₆中,Fe(CN)₆³⁻的Fe为+3价,另一Fe为+2价。
- 氧化反应:ClO₃⁻在酸性条件下氧化Fe²⁺,生成铵铁蓝:
$3\text{e}_2(\text{NH}_3)_2\text{Fe}(\text{CN})_6 + \text{ClO}_3^- + 6\text{H}^+ \rightarrow \text{GFe}(\text{NH}_4)_2\text{Fe}_2(\text{CN})_6 + 3\text{H}_2\text{O} + \text{Cl}^- + 6\text{NH}_4^+$
(6) 制备Fe₂O₃·xH₂O和(NH₄)₂SO₄的试剂
- H₂O₂:氧化Fe²⁺为Fe³⁺。
- NH₃·H₂O:调节pH使Fe³⁺水解生成Fe(OH)₃,过滤后灼烧得Fe₂O₃·xH₂O,母液蒸发结晶得(NH₄)₂SO₄。