题目
5.现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。-|||-(1) A+2B←C A+C←D

题目解答
答案
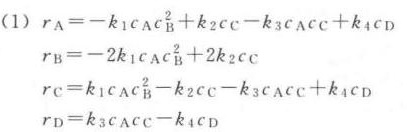
解析
本题考查基元反应的速率方程建立,核心在于正确分析各反应步骤的正逆过程对各物质浓度变化的影响。关键点如下:
- 可逆反应处理:每个反应均包含正、逆两个方向,需分别考虑其对物质浓度变化的贡献。
- 速率方程叠加:各物质的生成速率等于所有生成该物质的步骤速率之和,减去所有消耗该物质的步骤速率之和。
- 系数对应关系:反应式中物质的化学计量数需严格对应速率方程中的系数。
反应步骤分析
- 反应1:$A + 2B \xrightleftharpoons[k_2]{k_1} C$
- 正反应:$A + 2B \to C$,速率 $k_1[A][B]^2$
- 逆反应:$C \to A + 2B$,速率 $k_2[C]$
- 反应2:$A + C \xrightleftharpoons[k_4]{k_3} D$
- 正反应:$A + C \to D$,速率 $k_3[A][C]$
- 逆反应:$D \to A + C$,速率 $k_4[D]$
各物质生成速率推导
$r_A$(物质A的生成速率)
- 生成项:
- 逆反应1生成A:$k_2[C]$
- 逆反应2生成A:$k_4[D]$
- 消耗项:
- 正反应1消耗A:$k_1[A][B]^2$
- 正反应2消耗A:$k_3[A][C]$
- 综合:
$r_A = k_2[C] + k_4[D] - k_1[A][B]^2 - k_3[A][C]$
$r_B$(物质B的生成速率)
- 生成项:
- 逆反应1生成B:$2k_2[C]$
- 消耗项:
- 正反应1消耗B:$2k_1[A][B]^2$
- 综合:
$r_B = 2k_2[C] - 2k_1[A][B]^2$
$r_C$(物质C的生成速率)
- 生成项:
- 正反应1生成C:$k_1[A][B]^2$
- 逆反应2生成C:$k_4[D]$
- 消耗项:
- 逆反应1消耗C:$k_2[C]$
- 正反应2消耗C:$k_3[A][C]$
- 综合:
$r_C = k_1[A][B]^2 + k_4[D] - k_2[C] - k_3[A][C]$
$r_D$(物质D的生成速率)
- 生成项:
- 正反应2生成D:$k_3[A][C]$
- 消耗项:
- 逆反应2消耗D:$k_4[D]$
- 综合:
$r_D = k_3[A][C] - k_4[D]$