9.300K时,有4.0g Ar(g)(可视为理想气体, _(Ar)=39.95gcdot mo(l)^-1 ),压强为506.6 kPa。今在等温下分-|||-别按以下两种过程:(1)等温可逆膨胀;(2)等温、等外压膨胀,膨胀至终态压强为202.6 kPa。分别计算这两-|||-种过程的Q,W, Delta CF 和 Delta F(I)_(0)

题目解答
答案
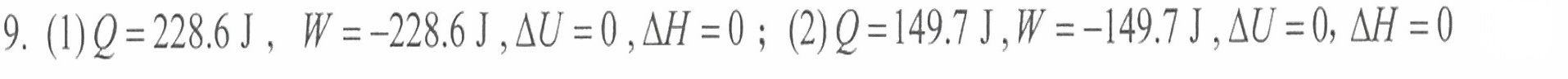
解析
考查要点:本题主要考查理想气体在等温过程中的热力学量(Q、W、ΔU、ΔH)的计算,区分可逆过程与恒外压过程的差异。
解题核心思路:
- 等温条件:对于理想气体,ΔU = 0,ΔH = 0(内能和焓仅是温度的函数)。
- 功的计算:
- 可逆过程:利用公式 $W = -nRT \ln \frac{P_1}{P_2}$。
- 恒外压过程:利用公式 $W = -P_{\text{外}} \Delta V$,其中 $\Delta V = \frac{nRT}{P_2} - \frac{nRT}{P_1}$。
- 热Q的计算:根据热力学第一定律 $\Delta U = Q + W$,因 $\Delta U = 0$,得 $Q = -W$。
破题关键点:
- 确定物质的量:通过质量与摩尔质量计算 $n$。
- 区分两种过程的功公式:可逆过程与恒外压过程的功表达式不同。
第(1)题:等温可逆膨胀
计算物质的量
$n = \frac{4.0 \, \text{g}}{39.95 \, \text{g/mol}} \approx 0.1001 \, \text{mol}$
计算功
$W = -nRT \ln \frac{P_1}{P_2} = -0.1001 \times 8.314 \times 300 \times \ln \frac{506.6}{202.6} \approx -228.6 \, \text{J}$
计算热
$Q = -W = 228.6 \, \text{J}$
内能与焓变
$\Delta U = 0, \quad \Delta H = 0$
第(2)题:等温恒外压膨胀
计算体积变化
$\Delta V = \frac{nRT}{P_2} - \frac{nRT}{P_1} = nRT \left( \frac{1}{P_2} - \frac{1}{P_1} \right)$
代入数据:
$\Delta V \approx 0.1001 \times 8.314 \times 300 \times \left( \frac{1}{202.6} - \frac{1}{506.6} \right) \approx 0.7393 \, \text{L}$
计算功
$W = -P_{\text{外}} \Delta V = -202.6 \, \text{kPa} \times 0.7393 \, \text{L} \approx -149.7 \, \text{J}$
计算热
$Q = -W = 149.7 \, \text{J}$
内能与焓变
$\Delta U = 0, \quad \Delta H = 0$