题目
考虑S2-的水解,计算Ag2S在纯水中的溶解度。_(SP)=2.0times (10)^-49,H2S的_(SP)=2.0times (10)^-49,_(SP)=2.0times (10)^-49解:已知Ag2S在水溶液中按下式解离A. g2S_(SP)=2.0times (10)^-492Ag++S2- B. g2S溶解出来的S2-在溶液中有下列平衡关系 C. _(SP)=2.0times (10)^-49 D. _(SP)=2.0times (10)^-49 E. g2S的溶解度很小,所以溶液中S2-的浓度也很小,S2-水解产生的OH-浓度可以忽略不计,溶液的pH就是纯水的pH,等于7。但是,由于S2-水解,使Ag2S的溶解度增大,设其溶解度为s,则 F. _(SP)=2.0times (10)^-49 G. _(SP)=2.0times (10)^-49 _(SP)=2.0times (10)^-49 _(SP)=2.0times (10)^-49 l·L-1
考虑S2-的水解,计算Ag2S在纯水中的溶解度。
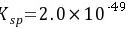 ,H2S的
,H2S的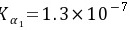 ,
,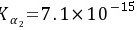
解:已知Ag2S在水溶液中按下式解离
A. g2S 2Ag++S2-
2Ag++S2-B. g2S溶解出来的S2-在溶液中有下列平衡关系
C.
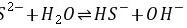
D.
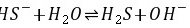
E. g2S的溶解度很小,所以溶液中S2-的浓度也很小,S2-水解产生的OH-浓度可以忽略不计,溶液的pH就是纯水的pH,等于7。但是,由于S2-水解,使Ag2S的溶解度增大,设其溶解度为s,则
F.
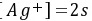
G.
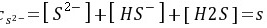
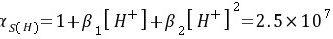
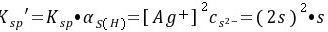
l·L-1
题目解答
答案
Ag 2 S 2Ag + +S 2- Ag 2 S溶解出来的S 2- 在溶液中有下列平衡关系 由于Ag 2 S的溶解度很小,所以溶液中S 2- 的浓度也很小,S 2- 水解产生的OH - 浓度可以忽略不计,溶液的pH就是纯水的pH,等于7。但是,由于S 2- 水解,使Ag 2 S的溶解度增大,设其溶解度为s,则 mol · L-1
解析
步骤 1:确定Ag2S的解离平衡
Ag2S在水溶液中按下式解离:
\[ Ag_2S \rightleftharpoons 2Ag^+ + S^{2-} \]
步骤 2:考虑S2-的水解平衡
S2-在溶液中有下列平衡关系:
\[ S^{2-} + H_2O \rightleftharpoons HS^- + OH^- \]
\[ HS^- + H_2O \rightleftharpoons H_2S + OH^- \]
步骤 3:计算S2-的水解平衡常数
由于Ag2S的溶解度很小,所以溶液中S2-的浓度也很小,S2-水解产生的OH-浓度可以忽略不计,溶液的pH就是纯水的pH,等于7。但是,由于S2-水解,使Ag2S的溶解度增大,设其溶解度为s,则:
\[ [Ag^+] = 2s \]
\[ [S^{2-}] + [HS^-] + [H_2S] = s \]
步骤 4:计算S2-的水解平衡常数
\[ K_{sp} = [Ag^+]^2 [S^{2-}] = (2s)^2 \cdot s = 4s^3 \]
步骤 5:计算S2-的水解平衡常数
\[ K_{sp} = 2.0 \times 10^{-48} \]
\[ 4s^3 = 2.0 \times 10^{-48} \]
\[ s^3 = \frac{2.0 \times 10^{-48}}{4} = 5.0 \times 10^{-49} \]
\[ s = \sqrt[3]{5.0 \times 10^{-49}} = 3.68 \times 10^{-17} \]
步骤 6:计算S2-的水解平衡常数
\[ s_{sp}(H) = 1 + \beta_1[H^+] + \beta_2[H^+]^2 = 2.5 \times 10^7 \]
步骤 7:计算S2-的水解平衡常数
\[ S_{sp}' = R_{sp} \cdot a_{S(H)} = [Ag^+]^2 [S^{2-}] = (2s)^2 \cdot s = 4s^3 \]
步骤 8:计算S2-的水解平衡常数
\[ S_{sp}' = 2.0 \times 10^{-48} \times 2.5 \times 10^7 = 5.0 \times 10^{-41} \]
步骤 9:计算S2-的水解平衡常数
\[ s = \sqrt[3]{5.0 \times 10^{-41}} = 3.68 \times 10^{-14} \]
Ag2S在水溶液中按下式解离:
\[ Ag_2S \rightleftharpoons 2Ag^+ + S^{2-} \]
步骤 2:考虑S2-的水解平衡
S2-在溶液中有下列平衡关系:
\[ S^{2-} + H_2O \rightleftharpoons HS^- + OH^- \]
\[ HS^- + H_2O \rightleftharpoons H_2S + OH^- \]
步骤 3:计算S2-的水解平衡常数
由于Ag2S的溶解度很小,所以溶液中S2-的浓度也很小,S2-水解产生的OH-浓度可以忽略不计,溶液的pH就是纯水的pH,等于7。但是,由于S2-水解,使Ag2S的溶解度增大,设其溶解度为s,则:
\[ [Ag^+] = 2s \]
\[ [S^{2-}] + [HS^-] + [H_2S] = s \]
步骤 4:计算S2-的水解平衡常数
\[ K_{sp} = [Ag^+]^2 [S^{2-}] = (2s)^2 \cdot s = 4s^3 \]
步骤 5:计算S2-的水解平衡常数
\[ K_{sp} = 2.0 \times 10^{-48} \]
\[ 4s^3 = 2.0 \times 10^{-48} \]
\[ s^3 = \frac{2.0 \times 10^{-48}}{4} = 5.0 \times 10^{-49} \]
\[ s = \sqrt[3]{5.0 \times 10^{-49}} = 3.68 \times 10^{-17} \]
步骤 6:计算S2-的水解平衡常数
\[ s_{sp}(H) = 1 + \beta_1[H^+] + \beta_2[H^+]^2 = 2.5 \times 10^7 \]
步骤 7:计算S2-的水解平衡常数
\[ S_{sp}' = R_{sp} \cdot a_{S(H)} = [Ag^+]^2 [S^{2-}] = (2s)^2 \cdot s = 4s^3 \]
步骤 8:计算S2-的水解平衡常数
\[ S_{sp}' = 2.0 \times 10^{-48} \times 2.5 \times 10^7 = 5.0 \times 10^{-41} \]
步骤 9:计算S2-的水解平衡常数
\[ s = \sqrt[3]{5.0 \times 10^{-41}} = 3.68 \times 10^{-14} \]