题目
设有一化学反应在298.15K及P下进行,放热41.84kJ。设在同样条件下,将此反应通过可逆原电池来完成,此时放热8.37kJ。试计算:(1)此反应的△S;(2)当此反应不在可逆原电池内发生时的△S一及△S,并判断此反应能否自动进行:(3)体系可能做的最大有效功
设有一化学反应在298.15K及P下进行,放热41.84kJ。设在同样条件下,将此反应
通过可逆原电池来完成,此时放热8.37kJ。试计算:(1)此反应的△S;(2)当此反应不
在可逆原电池内发生时的△S一及△S,并判断此反应能否自动进行:(3)体系可能做的
最大有效功
题目解答
答案
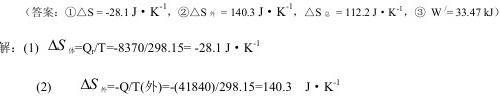
解析
步骤 1:计算反应的熵变($\Delta S$)
根据热力学第一定律,反应的熵变可以通过反应的热效应和温度来计算。在可逆条件下,反应的熵变可以通过反应的热效应和温度来计算。反应的热效应为放热41.84 kJ,温度为298.15 K。因此,反应的熵变可以通过以下公式计算:
$$\Delta S = \frac{-Q}{T}$$
其中,$Q$为反应的热效应,$T$为温度。将数值代入公式,得到:
$$\Delta S = \frac{-41840}{298.15} = -140.3 \quad J\cdot K^{-1}$$
步骤 2:计算环境的熵变($\Delta S_{环}$)
当反应不在可逆原电池内发生时,环境的熵变可以通过反应的热效应和温度来计算。反应的热效应为放热41.84 kJ,温度为298.15 K。因此,环境的熵变可以通过以下公式计算:
$$\Delta S_{环} = \frac{Q}{T}$$
其中,$Q$为反应的热效应,$T$为温度。将数值代入公式,得到:
$$\Delta S_{环} = \frac{41840}{298.15} = 140.3 \quad J\cdot K^{-1}$$
步骤 3:计算体系的熵变($\Delta S_{2}$)
体系的熵变可以通过反应的熵变和环境的熵变来计算。反应的熵变为-140.3 J·K^-1,环境的熵变为140.3 J·K^-1。因此,体系的熵变可以通过以下公式计算:
$$\Delta S_{2} = \Delta S + \Delta S_{环}$$
将数值代入公式,得到:
$$\Delta S_{2} = -140.3 + 140.3 = 0 \quad J\cdot K^{-1}$$
步骤 4:判断反应能否自动进行
反应能否自动进行取决于体系的熵变。如果体系的熵变大于0,则反应可以自动进行。如果体系的熵变小于0,则反应不能自动进行。如果体系的熵变为0,则反应处于平衡状态。根据步骤3的计算结果,体系的熵变为0,因此反应处于平衡状态。
步骤 5:计算体系可能做的最大有效功
体系可能做的最大有效功可以通过反应的热效应和温度来计算。反应的热效应为放热41.84 kJ,温度为298.15 K。因此,体系可能做的最大有效功可以通过以下公式计算:
$$W' = Q - T\Delta S$$
其中,$Q$为反应的热效应,$T$为温度,$\Delta S$为反应的熵变。将数值代入公式,得到:
$$W' = 41840 - 298.15 \times (-140.3) = 33470 \quad J = 33.47 \quad kJ$$
根据热力学第一定律,反应的熵变可以通过反应的热效应和温度来计算。在可逆条件下,反应的熵变可以通过反应的热效应和温度来计算。反应的热效应为放热41.84 kJ,温度为298.15 K。因此,反应的熵变可以通过以下公式计算:
$$\Delta S = \frac{-Q}{T}$$
其中,$Q$为反应的热效应,$T$为温度。将数值代入公式,得到:
$$\Delta S = \frac{-41840}{298.15} = -140.3 \quad J\cdot K^{-1}$$
步骤 2:计算环境的熵变($\Delta S_{环}$)
当反应不在可逆原电池内发生时,环境的熵变可以通过反应的热效应和温度来计算。反应的热效应为放热41.84 kJ,温度为298.15 K。因此,环境的熵变可以通过以下公式计算:
$$\Delta S_{环} = \frac{Q}{T}$$
其中,$Q$为反应的热效应,$T$为温度。将数值代入公式,得到:
$$\Delta S_{环} = \frac{41840}{298.15} = 140.3 \quad J\cdot K^{-1}$$
步骤 3:计算体系的熵变($\Delta S_{2}$)
体系的熵变可以通过反应的熵变和环境的熵变来计算。反应的熵变为-140.3 J·K^-1,环境的熵变为140.3 J·K^-1。因此,体系的熵变可以通过以下公式计算:
$$\Delta S_{2} = \Delta S + \Delta S_{环}$$
将数值代入公式,得到:
$$\Delta S_{2} = -140.3 + 140.3 = 0 \quad J\cdot K^{-1}$$
步骤 4:判断反应能否自动进行
反应能否自动进行取决于体系的熵变。如果体系的熵变大于0,则反应可以自动进行。如果体系的熵变小于0,则反应不能自动进行。如果体系的熵变为0,则反应处于平衡状态。根据步骤3的计算结果,体系的熵变为0,因此反应处于平衡状态。
步骤 5:计算体系可能做的最大有效功
体系可能做的最大有效功可以通过反应的热效应和温度来计算。反应的热效应为放热41.84 kJ,温度为298.15 K。因此,体系可能做的最大有效功可以通过以下公式计算:
$$W' = Q - T\Delta S$$
其中,$Q$为反应的热效应,$T$为温度,$\Delta S$为反应的熵变。将数值代入公式,得到:
$$W' = 41840 - 298.15 \times (-140.3) = 33470 \quad J = 33.47 \quad kJ$$