题目
某一个反应的速率常数k与温度的变化关系为ln k=-dfrac (4000)(T)+4-|||-__则该反应的活化能为________________。
某一个反应的速率常数k与温度的变化关系为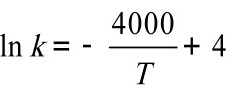 则该反应的活化能为________________。
则该反应的活化能为________________。
题目解答
答案
33256J·mol -1
解析
步骤 1:理解阿伦尼乌斯方程
阿伦尼乌斯方程描述了化学反应速率常数k与温度T之间的关系,方程为$\ln k = -\dfrac{E_a}{RT} + \ln A$,其中$E_a$是活化能,R是理想气体常数,A是频率因子。
步骤 2:比较给定方程与阿伦尼乌斯方程
给定方程为$\ln k=-\dfrac {4000}{T}+4$,与阿伦尼乌斯方程$\ln k = -\dfrac{E_a}{RT} + \ln A$对比,可以发现$-\dfrac{4000}{T}$对应$-\dfrac{E_a}{RT}$,而4对应$\ln A$。
步骤 3:计算活化能
根据步骤2的对比,可以得出$-\dfrac{4000}{T} = -\dfrac{E_a}{RT}$,从而$E_a = 4000R$。理想气体常数$R = 8.314 J\cdot mol^{-1}\cdot K^{-1}$,所以$E_a = 4000 \times 8.314 J\cdot mol^{-1} = 33256 J\cdot mol^{-1}$。
阿伦尼乌斯方程描述了化学反应速率常数k与温度T之间的关系,方程为$\ln k = -\dfrac{E_a}{RT} + \ln A$,其中$E_a$是活化能,R是理想气体常数,A是频率因子。
步骤 2:比较给定方程与阿伦尼乌斯方程
给定方程为$\ln k=-\dfrac {4000}{T}+4$,与阿伦尼乌斯方程$\ln k = -\dfrac{E_a}{RT} + \ln A$对比,可以发现$-\dfrac{4000}{T}$对应$-\dfrac{E_a}{RT}$,而4对应$\ln A$。
步骤 3:计算活化能
根据步骤2的对比,可以得出$-\dfrac{4000}{T} = -\dfrac{E_a}{RT}$,从而$E_a = 4000R$。理想气体常数$R = 8.314 J\cdot mol^{-1}\cdot K^{-1}$,所以$E_a = 4000 \times 8.314 J\cdot mol^{-1} = 33256 J\cdot mol^{-1}$。