题目
某校化学兴趣小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或加热的条件下均不反应.那么,铜与浓硫酸能否发生反应呢?他们就铜与浓硫酸是否能反应及相关问题进行了实验探究.残余-|||-浓硫酸 蘸有浓NaOH 溶液-|||-溶液的棉花-|||-Cu片 一 硫 水-|||-a-|||-石蕊溶液 足量-|||-锌粒-|||-A B C D E-|||-图1 图2-|||-量 准-|||-足量 管-|||-水 水 残余-|||-锌粒-|||-集气装置A 集气装置B 溶液-|||-图3 图4【探究一:铜与浓硫酸是否能反应?】同学们设计了如图1所示装置进行探究.①在常温下能反应;②常温下不能反应,但在加热条件下能反应;③在加热条件下不能反应;操作①:连接仪器,检查装置气密性;操作②:将过量的铜片放入试管中,加入浓硫酸,无明显现象;操作③:加热该试管,铜片上有气泡,试管内溶液由无色变为蓝色,产生了有刺激性气味的气体;…(1)写出仪器a的名称: ____ ;(2)甲同学认为,由以上实验过程可知:猜想 ____ (填序号)是正确的;(3)可观察到试管中的石蕊试液 ____ .乙同学认为,铜跟浓硫酸在加热条件下反应的产物只是SO2和CuSO4;(4)丙同学认为,在实验装置中,“蘸有浓NaOH溶液棉花”的作用是 ____ ,写出相关反应的化学方程式 ____ .(5)在(3)中对产物只是SO2和CuSO4的判断是否准确 ____ (填“是”或“否”),其理由是 ____ .写出铜与浓硫酸在加热条件下反应的化学方程式 ____ .(6)根据以上探究和已掌握的知识,该兴趣小组的同学设计了两种用铜制取硫酸铜的实验方案:方案一:Cu→_(加热)^浓硫酸CuSO4 方案二:Cu→_(加热)^O_(2)CuOstackrel(稀硫酸)(→)CuSO4经过对两种方案的讨论、对比,同学们认为方案二具有的优点有 ____ (填序号),所以工业上制备硫酸铜不是直接利用浓硫酸与铜反应.A.提高铜的利用率 B.提高硫酸的利用率 C.不产生污染大气的SO2【探究二:测定反应残余清液中硫酸的溶质质量分数】同学们对上述实验后试管内残余清液成分进行了讨论,过量的铜与浓硫酸在加热条件下反应不能将硫酸耗尽.为测定反应残余清液中硫酸的溶质质量分数,探究小组同学提出了下列实验方案::含杂质的锌与稀硫酸反应时比纯锌与稀硫酸反应更快,放出大量热:甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量.乙方案:与足量锌粒反应,测量生成氢气的体积.回答下列问题:(1)该反应中即使铜过量也不能将硫酸完全反应的原因是 ____ ;(2)甲方案是否可行? ____ (填“可行”或“不可行”),理由是 ____ ;(3)小王同学选用图2中的部分实验装置进行了乙方案的实验:①你认为图2中最简易的装置及其连接顺序是: ____ ;②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后残余清液就不能顺利滴入锥形瓶.其原因是 ____ (填序号);A.锌与硫酸铜反应生成了铜,不纯的锌与硫酸反应速率加快;B.反应产生大量气体且放热,使瓶中压强增大;③某学生想用排水法收集氢气并检验其纯度,应选择图3中的集气装置 ____ (填“A”或“B”).(4)小张同学用如图4所示装置进行了乙方案的实验①连接仪器,检查此装置气密性.下列能说明装置气密性良好的是 ____ (填序号);A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差.B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平.②实验中使Y形管中的残余清液与锌粒反应的正确操作是倾斜,将 ____ (选填“锌粒”或“残余清液”)转移到Y形管的另一边.残余清液与锌粒混合后的现象是锌粒逐渐溶解、 ____ 、产生大量气泡,放出热量.③反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变.气体体积逐渐减小的原因是 ____ (排除仪器和实验操作的影响因素).④该实验中残余清液质量为a g,测得生成气体体积为bmL(假设在实验条件下气体密度为cg/mL),残余清液中硫酸的溶质质量分数为 ____ (用含a、b、c的式子表示).⑤若实验中测得残余清液中硫酸的溶质质量分数偏大,下列可能的原因是 ____ .a.装置漏气 b.读取数据时水准管的水面高于量气管的水面 c.未待冷却就读取量气管读数.
某校化学兴趣小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或加热的条件下均不反应.那么,铜与浓硫酸能否发生反应呢?他们就铜与浓硫酸是否能反应及相关问题进行了实验探究.
【探究一:铜与浓硫酸是否能反应?】
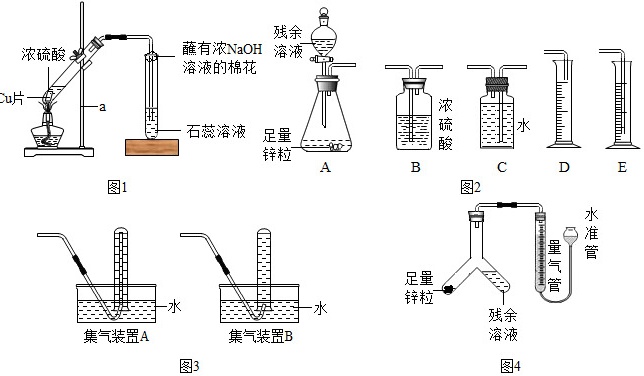
同学们设计了如图1所示装置进行探究.
①在常温下能反应;
②常温下不能反应,但在加热条件下能反应;
③在加热条件下不能反应;
操作①:连接仪器,检查装置气密性;
操作②:将过量的铜片放入试管中,加入浓硫酸,无明显现象;
操作③:加热该试管,铜片上有气泡,试管内溶液由无色变为蓝色,产生了有刺激性气味的气体;…
(1)写出仪器a的名称: ____ ;
(2)甲同学认为,由以上实验过程可知:猜想 ____ (填序号)是正确的;
(3)可观察到试管中的石蕊试液 ____ .
乙同学认为,铜跟浓硫酸在加热条件下反应的产物只是SO2和CuSO4;
(4)丙同学认为,在实验装置中,“蘸有浓NaOH溶液棉花”的作用是 ____ ,写出相关反应的化学方程式 ____ .
(5)在(3)中对产物只是SO2和CuSO4的判断是否准确 ____ (填“是”或“否”),其理由是 ____ .写出铜与浓硫酸在加热条件下反应的化学方程式 ____ .
(6)根据以上探究和已掌握的知识,该兴趣小组的同学设计了两种用铜制取硫酸铜的实验方案:
方案一:Cu$→_{加热}^{浓硫酸}$CuSO4 方案二:Cu$→_{加热}^{O_{2}}$CuO$\stackrel{稀硫酸}{→}$CuSO4
经过对两种方案的讨论、对比,同学们认为方案二具有的优点有 ____ (填序号),所以工业上制备硫酸铜不是直接利用浓硫酸与铜反应.
A.提高铜的利用率 B.提高硫酸的利用率 C.不产生污染大气的SO2
【探究二:测定反应残余清液中硫酸的溶质质量分数】
同学们对上述实验后试管内残余清液成分进行了讨论,过量的铜与浓硫酸在加热条件下反应不能将硫酸耗尽.为测定反应残余清液中硫酸的溶质质量分数,探究小组同学提出了下列实验方案:
:含杂质的锌与稀硫酸反应时比纯锌与稀硫酸反应更快,放出大量热
:甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量.
乙方案:与足量锌粒反应,测量生成氢气的体积.
回答下列问题:
(1)该反应中即使铜过量也不能将硫酸完全反应的原因是 ____ ;
(2)甲方案是否可行? ____ (填“可行”或“不可行”),理由是 ____ ;
(3)小王同学选用图2中的部分实验装置进行了乙方案的实验:
①你认为图2中最简易的装置及其连接顺序是: ____ ;
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后残余清液就不能顺利滴入锥形瓶.其原因是 ____ (填序号);
A.锌与硫酸铜反应生成了铜,不纯的锌与硫酸反应速率加快;
B.反应产生大量气体且放热,使瓶中压强增大;
③某学生想用排水法收集氢气并检验其纯度,应选择图3中的集气装置 ____ (填“A”或“B”).
(4)小张同学用如图4所示装置进行了乙方案的实验
①连接仪器,检查此装置气密性.下列能说明装置气密性良好的是 ____ (填序号);
A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差.
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平.
②实验中使Y形管中的残余清液与锌粒反应的正确操作是倾斜,将 ____ (选填“锌粒”或“残余清液”)转移到Y形管的另一边.残余清液与锌粒混合后的现象是锌粒逐渐溶解、
____ 、产生大量气泡,放出热量.
③反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变.气体体积逐渐减小的原因是 ____ (排除仪器和实验操作的影响因素).
④该实验中残余清液质量为a g,测得生成气体体积为bmL(假设在实验条件下气体密度为cg/mL),残余清液中硫酸的溶质质量分数为 ____ (用含a、b、c的式子表示).
⑤若实验中测得残余清液中硫酸的溶质质量分数偏大,下列可能的原因是 ____ .
a.装置漏气 b.读取数据时水准管的水面高于量气管的水面 c.未待冷却就读取量气管读数.

【探究一:铜与浓硫酸是否能反应?】
同学们设计了如图1所示装置进行探究.
①在常温下能反应;
②常温下不能反应,但在加热条件下能反应;
③在加热条件下不能反应;
操作①:连接仪器,检查装置气密性;
操作②:将过量的铜片放入试管中,加入浓硫酸,无明显现象;
操作③:加热该试管,铜片上有气泡,试管内溶液由无色变为蓝色,产生了有刺激性气味的气体;…
(1)写出仪器a的名称: ____ ;
(2)甲同学认为,由以上实验过程可知:猜想 ____ (填序号)是正确的;
(3)可观察到试管中的石蕊试液 ____ .
乙同学认为,铜跟浓硫酸在加热条件下反应的产物只是SO2和CuSO4;
(4)丙同学认为,在实验装置中,“蘸有浓NaOH溶液棉花”的作用是 ____ ,写出相关反应的化学方程式 ____ .
(5)在(3)中对产物只是SO2和CuSO4的判断是否准确 ____ (填“是”或“否”),其理由是 ____ .写出铜与浓硫酸在加热条件下反应的化学方程式 ____ .
(6)根据以上探究和已掌握的知识,该兴趣小组的同学设计了两种用铜制取硫酸铜的实验方案:
方案一:Cu$→_{加热}^{浓硫酸}$CuSO4 方案二:Cu$→_{加热}^{O_{2}}$CuO$\stackrel{稀硫酸}{→}$CuSO4
经过对两种方案的讨论、对比,同学们认为方案二具有的优点有 ____ (填序号),所以工业上制备硫酸铜不是直接利用浓硫酸与铜反应.
A.提高铜的利用率 B.提高硫酸的利用率 C.不产生污染大气的SO2
【探究二:测定反应残余清液中硫酸的溶质质量分数】
同学们对上述实验后试管内残余清液成分进行了讨论,过量的铜与浓硫酸在加热条件下反应不能将硫酸耗尽.为测定反应残余清液中硫酸的溶质质量分数,探究小组同学提出了下列实验方案:
:含杂质的锌与稀硫酸反应时比纯锌与稀硫酸反应更快,放出大量热
:甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量.
乙方案:与足量锌粒反应,测量生成氢气的体积.
回答下列问题:
(1)该反应中即使铜过量也不能将硫酸完全反应的原因是 ____ ;
(2)甲方案是否可行? ____ (填“可行”或“不可行”),理由是 ____ ;
(3)小王同学选用图2中的部分实验装置进行了乙方案的实验:
①你认为图2中最简易的装置及其连接顺序是: ____ ;
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后残余清液就不能顺利滴入锥形瓶.其原因是 ____ (填序号);
A.锌与硫酸铜反应生成了铜,不纯的锌与硫酸反应速率加快;
B.反应产生大量气体且放热,使瓶中压强增大;
③某学生想用排水法收集氢气并检验其纯度,应选择图3中的集气装置 ____ (填“A”或“B”).
(4)小张同学用如图4所示装置进行了乙方案的实验
①连接仪器,检查此装置气密性.下列能说明装置气密性良好的是 ____ (填序号);
A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差.
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平.
②实验中使Y形管中的残余清液与锌粒反应的正确操作是倾斜,将 ____ (选填“锌粒”或“残余清液”)转移到Y形管的另一边.残余清液与锌粒混合后的现象是锌粒逐渐溶解、
____ 、产生大量气泡,放出热量.
③反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变.气体体积逐渐减小的原因是 ____ (排除仪器和实验操作的影响因素).
④该实验中残余清液质量为a g,测得生成气体体积为bmL(假设在实验条件下气体密度为cg/mL),残余清液中硫酸的溶质质量分数为 ____ (用含a、b、c的式子表示).
⑤若实验中测得残余清液中硫酸的溶质质量分数偏大,下列可能的原因是 ____ .
a.装置漏气 b.读取数据时水准管的水面高于量气管的水面 c.未待冷却就读取量气管读数.
题目解答
答案
解:【探究一:铜与浓硫酸是否能反应?】
(1)根据实验室常用仪器可知:a的名称是铁架台;
(2)根据实验操作和现象,可以证明铜和浓硫酸在加热的时候能反应,生成物中有二氧化硫和硫酸铜,所以猜想②正确;
(3)可观察到试管中的石蕊试液变红;
(4)二氧化硫有毒,能和碱溶液反应,所以可以用浓碱液吸收;反应的化学方程式为:2NaOH+SO2═Na2SO3+H2O;
(5)因为反应物中有氢,硫、氧、铜四种元素,根据反应前后元素的种类不变的原则,生成物中应该有氢元素;浓硫酸具有强氧化性,可以在加热的条件下与铜反应生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(6)比较这两个方案,从经济,环保,安全的角度考虑,浓硫酸使用时要注意安全,二氧化硫有毒等,通过综合考虑,方案二比一要好的多,故选:BC;
【探究二:测定反应残余清液中硫酸的溶质质量分数】
(1)该反应中即使铜过量也不能将硫酸完全反应的原因是物质的化学性质除了与物质本身的性质有关,还可能和溶液中溶质的浓度有关.
(2)甲方案不可行,没有溶液的体积,加入足量的BaCl2溶液只能求出硫酸根离子的量,而不能求出剩余硫酸的浓度;
(3)①测量氢气的体积,导管应伸到量筒下部,保证压强平衡,最简易的装置其连接顺序ACE;
②锌与残余清液中硫酸铜反应生成铜,铜锌形成原池,使锌与硫酸反应速率加快,反应生成大量气体且放热,导致锥形瓶内压强增大;
③氢气密度比空气小,用排水法收集氢气,应短进;
(4)①用液压法检验装置气密性,连接装置后,向量气管右端注水,直到左右两边管子形成一段液面差,一段时间后液面差不变;
②将固体加入液体中,Zn粒与铜离子反应生成铜单质,并且生成气体,实验现象是表面析出暗红色固体,有大量气泡,锌粒部分溶解;
③此反应为放热反应,气体受热膨胀,未冷却,故答案为:反应是放热的,气体未冷却;
(3)①测量氢气的体积,最简易的装置其连接顺序EDG,故答案为:EDG;
②锌与残余清液中硫酸铜反应生成铜,铜锌形成原池,使锌与硫酸反应速率加快,反应生成大量气体且放热,导致锥形瓶内压强增大
③设残余清液中硫酸的溶质质量为x,氢气的质量=bmL×cg/mL=bcg
Zn+H2SO4═ZnSO4+H2↑;
98 2
x bcg
$\frac{98}{x}=\frac{2}{bcg}$
x=$\frac{98bc}{2}g$=49bcg
残余清液中硫酸的溶质质量分数为$\frac{49bcg}{ag}×$100%=$\frac{49bc}{a}×$100%;
⑤若实验中测得残余清液中硫酸的溶质质量分数偏大,在给定的三种可能中,a是导致读数偏小,b是读取数据时水准管的水面高于量气管的水面,这样导致压强大于应该数值,而使气体体积偏小,读数偏小,会所以ab都是导致测定的质量分数偏小.C由于没有恢复到室温读数,导致读数偏大,所以测定的质量分数也就偏大.
故答案为:
(1)铁架台;
(1)②;
(3)变红;
(4)吸收SO2;2NaOH+SO2═Na2SO3+H2O;
(5)否,反应物中有氢元素,但二氧化硫和硫酸铜中都不含氢元素;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(6)BC;
【探究二:测定反应残余清液中硫酸的溶质质量分数】
(1)物质的化学性质除了与物质本身的性质有关,还可能和溶液中溶质的浓度有关;
(2)不可行;加入足量的BaCl2溶液只能求出硫酸根离子的量,而不能求出剩余硫酸的浓度;
(3)①ACE;②AB;③B;
(4)①A;②锌粒;表面析出暗红色固体;③反应是放热的,气体未冷却;④$\frac{49bc}{a}×$100%;⑤c
(1)根据实验室常用仪器可知:a的名称是铁架台;
(2)根据实验操作和现象,可以证明铜和浓硫酸在加热的时候能反应,生成物中有二氧化硫和硫酸铜,所以猜想②正确;
(3)可观察到试管中的石蕊试液变红;
(4)二氧化硫有毒,能和碱溶液反应,所以可以用浓碱液吸收;反应的化学方程式为:2NaOH+SO2═Na2SO3+H2O;
(5)因为反应物中有氢,硫、氧、铜四种元素,根据反应前后元素的种类不变的原则,生成物中应该有氢元素;浓硫酸具有强氧化性,可以在加热的条件下与铜反应生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(6)比较这两个方案,从经济,环保,安全的角度考虑,浓硫酸使用时要注意安全,二氧化硫有毒等,通过综合考虑,方案二比一要好的多,故选:BC;
【探究二:测定反应残余清液中硫酸的溶质质量分数】
(1)该反应中即使铜过量也不能将硫酸完全反应的原因是物质的化学性质除了与物质本身的性质有关,还可能和溶液中溶质的浓度有关.
(2)甲方案不可行,没有溶液的体积,加入足量的BaCl2溶液只能求出硫酸根离子的量,而不能求出剩余硫酸的浓度;
(3)①测量氢气的体积,导管应伸到量筒下部,保证压强平衡,最简易的装置其连接顺序ACE;
②锌与残余清液中硫酸铜反应生成铜,铜锌形成原池,使锌与硫酸反应速率加快,反应生成大量气体且放热,导致锥形瓶内压强增大;
③氢气密度比空气小,用排水法收集氢气,应短进;
(4)①用液压法检验装置气密性,连接装置后,向量气管右端注水,直到左右两边管子形成一段液面差,一段时间后液面差不变;
②将固体加入液体中,Zn粒与铜离子反应生成铜单质,并且生成气体,实验现象是表面析出暗红色固体,有大量气泡,锌粒部分溶解;
③此反应为放热反应,气体受热膨胀,未冷却,故答案为:反应是放热的,气体未冷却;
(3)①测量氢气的体积,最简易的装置其连接顺序EDG,故答案为:EDG;
②锌与残余清液中硫酸铜反应生成铜,铜锌形成原池,使锌与硫酸反应速率加快,反应生成大量气体且放热,导致锥形瓶内压强增大
③设残余清液中硫酸的溶质质量为x,氢气的质量=bmL×cg/mL=bcg
Zn+H2SO4═ZnSO4+H2↑;
98 2
x bcg
$\frac{98}{x}=\frac{2}{bcg}$
x=$\frac{98bc}{2}g$=49bcg
残余清液中硫酸的溶质质量分数为$\frac{49bcg}{ag}×$100%=$\frac{49bc}{a}×$100%;
⑤若实验中测得残余清液中硫酸的溶质质量分数偏大,在给定的三种可能中,a是导致读数偏小,b是读取数据时水准管的水面高于量气管的水面,这样导致压强大于应该数值,而使气体体积偏小,读数偏小,会所以ab都是导致测定的质量分数偏小.C由于没有恢复到室温读数,导致读数偏大,所以测定的质量分数也就偏大.
故答案为:
(1)铁架台;
(1)②;
(3)变红;
(4)吸收SO2;2NaOH+SO2═Na2SO3+H2O;
(5)否,反应物中有氢元素,但二氧化硫和硫酸铜中都不含氢元素;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(6)BC;
【探究二:测定反应残余清液中硫酸的溶质质量分数】
(1)物质的化学性质除了与物质本身的性质有关,还可能和溶液中溶质的浓度有关;
(2)不可行;加入足量的BaCl2溶液只能求出硫酸根离子的量,而不能求出剩余硫酸的浓度;
(3)①ACE;②AB;③B;
(4)①A;②锌粒;表面析出暗红色固体;③反应是放热的,气体未冷却;④$\frac{49bc}{a}×$100%;⑤c