题目
用络合滴定法测定铝盐中的铝,称取试样0.2500g,溶解后加入0.05000mol•L-1EDTA 25.00mL,在适当条件下使Al(Ⅲ)络合完全,调节PH 5—6加入二甲酚橙指示剂,用0.02000 mol•L-1Zn(Ac)2溶液21.50 mL滴定至终点,计算试样中Al%和Al2O3%。
用络合滴定法测定铝盐中的铝,称取试样0.2500g,溶解后加入0.05000mol•L-1EDTA 25.00mL,在适当条件下使Al(Ⅲ)络合完全,调节PH 5—6加入二甲酚橙指示剂,用0.02000 mol•L-1Zn(Ac)2溶液21.50 mL滴定至终点,计算试样中Al%和Al2O3%。
题目解答
答案
解:已知:MAl=26.98 MAl2O3=56.08
nZn=0.02000mol/L×21.50×10-3=4.3×10-4mol/L nZn= nEDTA
nEDTA总=0.05000×25.000×10-3=1.25×10-3mol/L
Al消耗EDTA的摩尔数为nAl= nEDTA总–nZn=1.25×10-3–4.3×10-4=8.20×10-4mol
Al的含量%=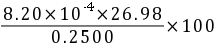 =8.85%
=8.85%
Al2O3的含量%=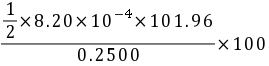 =16.72%
=16.72%
解析
步骤 1:计算Zn(Ac)2的摩尔数
根据题目,Zn(Ac)2的浓度为0.02000 mol•L-1,体积为21.50 mL,因此Zn(Ac)2的摩尔数为:
nZn = 0.02000 mol•L-1 × 21.50 × 10-3 L = 4.30 × 10-4 mol
步骤 2:计算EDTA的总摩尔数
EDTA的浓度为0.05000 mol•L-1,体积为25.00 mL,因此EDTA的总摩尔数为:
nEDTA总 = 0.05000 mol•L-1 × 25.00 × 10-3 L = 1.25 × 10-3 mol
步骤 3:计算Al(Ⅲ)消耗的EDTA的摩尔数
由于Zn(Ac)2与EDTA反应,消耗了部分EDTA,因此Al(Ⅲ)消耗的EDTA的摩尔数为:
nAl = nEDTA总 - nZn = 1.25 × 10-3 mol - 4.30 × 10-4 mol = 8.20 × 10-4 mol
步骤 4:计算试样中Al%和Al2O3%
根据Al的摩尔数和试样的质量,可以计算出试样中Al%和Al2O3%:
Al% = (8.20 × 10-4 mol × 26.98 g/mol) / 0.2500 g × 100% = 8.85%
Al2O3% = (1/2 × 8.20 × 10-4 mol × 101.96 g/mol) / 0.2500 g × 100% = 16.72%
根据题目,Zn(Ac)2的浓度为0.02000 mol•L-1,体积为21.50 mL,因此Zn(Ac)2的摩尔数为:
nZn = 0.02000 mol•L-1 × 21.50 × 10-3 L = 4.30 × 10-4 mol
步骤 2:计算EDTA的总摩尔数
EDTA的浓度为0.05000 mol•L-1,体积为25.00 mL,因此EDTA的总摩尔数为:
nEDTA总 = 0.05000 mol•L-1 × 25.00 × 10-3 L = 1.25 × 10-3 mol
步骤 3:计算Al(Ⅲ)消耗的EDTA的摩尔数
由于Zn(Ac)2与EDTA反应,消耗了部分EDTA,因此Al(Ⅲ)消耗的EDTA的摩尔数为:
nAl = nEDTA总 - nZn = 1.25 × 10-3 mol - 4.30 × 10-4 mol = 8.20 × 10-4 mol
步骤 4:计算试样中Al%和Al2O3%
根据Al的摩尔数和试样的质量,可以计算出试样中Al%和Al2O3%:
Al% = (8.20 × 10-4 mol × 26.98 g/mol) / 0.2500 g × 100% = 8.85%
Al2O3% = (1/2 × 8.20 × 10-4 mol × 101.96 g/mol) / 0.2500 g × 100% = 16.72%