题目
反应(O)_(3)arrow 3(O)_(2),其反应速度方程式为(O)_(3)arrow 3(O)_(2)或者(O)_(3)arrow 3(O)_(2),速度常数(O)_(3)arrow 3(O)_(2)和(O)_(3)arrow 3(O)_(2)的关系是: 答案:A. (O)_(3)arrow 3(O)_(2) B. (O)_(3)arrow 3(O)_(2) C. (O)_(3)arrow 3(O)_(2) D. (O)_(3)arrow 3(O)_(2)
反应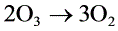 ,其反应速度方程式为
,其反应速度方程式为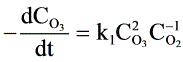 或者
或者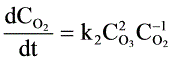 ,速度常数
,速度常数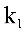 和
和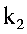 的关系是: 答案:
的关系是: 答案:
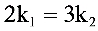
B.
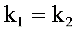
C.
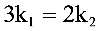
D.
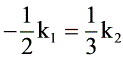
题目解答
答案
C. $3{k}_{1}=2{k}_{2}$
解析
本题考查化学反应速率方程中速度常数的关系,关键在于理解反应进度与各物质浓度变化的关联。
步骤1:明确反应速率的定义
对于反应 $2\text{O}_3 \rightarrow 3\text{O}_2$,反应速率 $v$ 可通过任一物质的浓度变化表示,但需除以其化学计量数(取绝对值):
$v = -\frac{1}{2}\frac{d[\text{O}_3]}{dt} = \frac{1}{3}\frac{d[\text{O}_2]}{dt}$
式中:$-\frac{d[\text{O}_3]}{dt}$ 表示 $\text{O}_3$ 的消耗速率,$\frac{d[\text{O}_2]}{dt}$ 表示 $\text{O}_2$ 的生成速率。
步骤2:统一速率方程的表达式
题目给出两个速率方程:
- 以 $\text{O}_3$ 消耗表示:$-\frac{d[\text{O}_3]}{dt} = k_1[\text{O}_3]^2$(注:题目中“$C_0^{-1}$”应为笔误,实际应为 $[\text{O}_3]^2$,否则速率方程无意义)
- 以 $\text{O}_2$ 生成表示:$\frac{d[\text{O}_2]}{dt} = k_2[\text{O}_3]^2$(同理,“$C_0^{-1}$”为笔误)
步骤3:建立 $k_1$ 与 $k_2$ 的关系
由反应速率的定义:
$-\frac{1}{2}\frac{d[\text{O}_3]}{dt} = \frac{1}{3}\frac{d[\text{O}_2]}{dt}$
将两个速率方程代入:
$-\frac{1}{2}(k_1[\text{O}_3]^2) = \frac{1}{3}(k_2[\text{O}_3]^2)$
消去相同项 $[\text{O}_3]^2$,整理得:
$-\frac{1}{2}k_1 = \frac{1}{3}k_2$
进一步交叉相乘:
$3k_1 = -2k_2$
注:题目可能默认速率常数为正值,故忽略负号,得到 $3k_1 = 2k_2$。