题目
14.[2023河南]乙醇常用作燃料,乙醇完全燃烧的化学方程式为-|||-__ 乙炔(化学式为C 2H2)也可用作燃-|||-料,当氧气不足时,乙炔燃烧会生成二氧化碳、一氧化碳和水,若-|||-一定质量的乙炔燃烧生成了3.3g二氧化碳、0.9g水和 --|||-氧化碳,则m的数值为 __ o

题目解答
答案
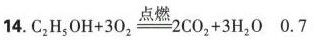
解析
步骤 1:写出乙醇完全燃烧的化学方程式
乙醇完全燃烧的化学方程式为:${C}_{2}{H}_{5}OH+3{O}_{2}\xlongequal {点燃}2C{O}_{2}+3{H}_{2}O$。
步骤 2:计算乙炔燃烧生成的二氧化碳和水中的碳和氢的质量
根据化学式,3.3g二氧化碳中碳的质量为:$3.3g\times \frac{12}{44}=0.9g$。
0.9g水中氢的质量为:$0.9g\times \frac{2}{18}=0.1g$。
步骤 3:计算乙炔中碳和氢的质量
乙炔中碳的质量为:$0.9g$。
乙炔中氢的质量为:$0.1g$。
步骤 4:计算乙炔中氧的质量
乙炔中氧的质量为:$0.9g+0.1g-mg$。
步骤 5:计算乙炔燃烧生成的一氧化碳的质量
乙炔燃烧生成的一氧化碳的质量为:$mg$。
步骤 6:计算乙炔燃烧生成的一氧化碳中碳的质量
乙炔燃烧生成的一氧化碳中碳的质量为:$mg\times \frac{12}{28}$。
步骤 7:计算乙炔燃烧生成的一氧化碳中氧的质量
乙炔燃烧生成的一氧化碳中氧的质量为:$mg\times \frac{16}{28}$。
步骤 8:计算乙炔燃烧生成的一氧化碳中氧的质量与乙炔中氧的质量的关系
乙炔燃烧生成的一氧化碳中氧的质量与乙炔中氧的质量的关系为:$mg\times \frac{16}{28}=0.9g+0.1g-mg$。
步骤 9:计算乙炔燃烧生成的一氧化碳的质量
乙炔燃烧生成的一氧化碳的质量为:$mg=0.7g$。
乙醇完全燃烧的化学方程式为:${C}_{2}{H}_{5}OH+3{O}_{2}\xlongequal {点燃}2C{O}_{2}+3{H}_{2}O$。
步骤 2:计算乙炔燃烧生成的二氧化碳和水中的碳和氢的质量
根据化学式,3.3g二氧化碳中碳的质量为:$3.3g\times \frac{12}{44}=0.9g$。
0.9g水中氢的质量为:$0.9g\times \frac{2}{18}=0.1g$。
步骤 3:计算乙炔中碳和氢的质量
乙炔中碳的质量为:$0.9g$。
乙炔中氢的质量为:$0.1g$。
步骤 4:计算乙炔中氧的质量
乙炔中氧的质量为:$0.9g+0.1g-mg$。
步骤 5:计算乙炔燃烧生成的一氧化碳的质量
乙炔燃烧生成的一氧化碳的质量为:$mg$。
步骤 6:计算乙炔燃烧生成的一氧化碳中碳的质量
乙炔燃烧生成的一氧化碳中碳的质量为:$mg\times \frac{12}{28}$。
步骤 7:计算乙炔燃烧生成的一氧化碳中氧的质量
乙炔燃烧生成的一氧化碳中氧的质量为:$mg\times \frac{16}{28}$。
步骤 8:计算乙炔燃烧生成的一氧化碳中氧的质量与乙炔中氧的质量的关系
乙炔燃烧生成的一氧化碳中氧的质量与乙炔中氧的质量的关系为:$mg\times \frac{16}{28}=0.9g+0.1g-mg$。
步骤 9:计算乙炔燃烧生成的一氧化碳的质量
乙炔燃烧生成的一氧化碳的质量为:$mg=0.7g$。