5.已知HNO3(1)在0℃及100℃的蒸气压分别为1.92kP a及171kPa。试计算:-|||-(1)HNO3(1)在此温度范围内的摩尔汽化焓;-|||-(2)HNO3(1)的正常沸点。

题目解答
答案
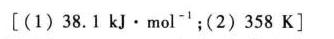
解析
考查要点:本题主要考查克劳修斯-克拉佩龙方程的应用,涉及汽化焓的计算和正常沸点的确定。
解题核心思路:
- 汽化焓计算:利用克劳修斯-克拉佩龙方程的积分形式,结合两个温度下的蒸气压数据,建立方程求解。
- 正常沸点计算:假设汽化焓为常数,利用克劳修斯-克拉佩龙方程,求解蒸气压为100 kPa时的温度。
破题关键点:
- 公式选择:正确应用克劳修斯-克拉佩龙方程 $\ln\left(\frac{P_2}{P_1}\right) = -\frac{\Delta H_{\text{vap}}}{R}\left(\frac{1}{T_2} - \frac{1}{T_1}\right)$。
- 单位统一:温度需转换为开尔文,压力单位保持一致(kPa即可)。
- 方程变形:根据已知条件灵活变形方程,求解目标变量。
第(1)题:摩尔汽化焓计算
步骤1:代入克劳修斯-克拉佩龙方程
已知:
- $T_1 = 0^\circ\text{C} = 273.15\ \text{K}$,$P_1 = 1.92\ \text{kPa}$
- $T_2 = 100^\circ\text{C} = 373.15\ \text{K}$,$P_2 = 171\ \text{kPa}$
- 气体常数 $R = 8.314\ \text{J/mol·K}$
方程变形为:
$\ln\left(\frac{171}{1.92}\right) = -\frac{\Delta H_{\text{vap}}}{8.314} \left(\frac{1}{373.15} - \frac{1}{273.15}\right)$
步骤2:计算左边对数项
$\ln\left(\frac{171}{1.92}\right) \approx \ln(89.06) \approx 4.486$
步骤3:计算右边温度项
$\frac{1}{373.15} - \frac{1}{273.15} \approx 0.002679 - 0.003661 = -0.000982$
步骤4:解方程求$\Delta H_{\text{vap}}$
$4.486 = -\frac{\Delta H_{\text{vap}}}{8.314} \cdot (-0.000982) \\ \Delta H_{\text{vap}} = \frac{4.486 \cdot 8.314}{0.000982} \approx 38.1\ \text{kJ/mol}$
第(2)题:正常沸点计算
步骤1:设定方程
当蒸气压 $P = 100\ \text{kPa}$,利用克劳修斯-克拉佩龙方程:
$\ln\left(\frac{100}{1.92}\right) = -\frac{38100}{8.314} \left(\frac{1}{T_b} - \frac{1}{273.15}\right)$
步骤2:计算左边对数项
$\ln\left(\frac{100}{1.92}\right) \approx \ln(52.08) \approx 3.952$
步骤3:代入已知值并解方程
$3.952 = -4580.7 \left(\frac{1}{T_b} - 0.003661\right) \\ \frac{1}{T_b} - 0.003661 = -\frac{3.952}{4580.7} \approx -0.0008626 \\ \frac{1}{T_b} \approx 0.0027984 \\ T_b \approx \frac{1}{0.0027984} \approx 358\ \text{K}$