题目
焓↑ -反应物-|||-Delta H-|||-生成物已知氮化硅陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2frac(underline{;高温;)}{}Si3N4+6CO。该反应过程中的能量变化如图所示:(1)该反应是 ____ (填“吸热反应”或“放热反应”),△H ____ (填“>”“<”或“=”)0。(2)该反应过程中,断裂旧化学键吸收的总能量 ____ (填“>”“<”或“=”)形成新化学键释放的总能量。(3)据题意判断物质N2与CO具有的能量大小关系: ____ (填“N2>CO““N2<CO“或“无法比较”)。
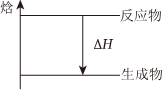 已知氮化硅陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{}$Si3N4+6CO。该反应过程中的能量变化如图所示:
已知氮化硅陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{}$Si3N4+6CO。该反应过程中的能量变化如图所示:(1)该反应是 ____ (填“吸热反应”或“放热反应”),△H ____ (填“>”“<”或“=”)0。
(2)该反应过程中,断裂旧化学键吸收的总能量 ____ (填“>”“<”或“=”)形成新化学键释放的总能量。
(3)据题意判断物质N2与CO具有的能量大小关系: ____ (填“N2>CO““N2<CO“或“无法比较”)。
题目解答
答案
解:(1)由图可知,反应物的总能量大于生成物的总能量,则反应是放热反应,△H<0,
故答案为:放热反应;<;
(2)由图可知,该反应是放热反应,则断裂旧化学键吸收的总能量小于形成新化学键释放的总能量,
故答案为:<;
(3)该反应中N2为反应物,CO为生成物,均为部分物质,不能根据反应热比较N2与CO具有的能量大小,
故答案为:无法比较。
故答案为:放热反应;<;
(2)由图可知,该反应是放热反应,则断裂旧化学键吸收的总能量小于形成新化学键释放的总能量,
故答案为:<;
(3)该反应中N2为反应物,CO为生成物,均为部分物质,不能根据反应热比较N2与CO具有的能量大小,
故答案为:无法比较。
解析
- 反应的吸放热判断:根据反应物和生成物的总能量关系,若反应物总能量高于生成物,则反应为放热反应,反之为吸热反应。ΔH的符号由总能量变化决定。
- 键能与能量变化关系:放热反应中,断裂旧键吸收的总能量小于形成新键释放的总能量;吸热反应则相反。
- 物质能量比较:反应物和生成物中物质的能量无法直接通过反应方向判断,需结合具体条件或键能数据。
第(1)题
判断反应类型
从能量变化图可知,反应物的总能量高于生成物的总能量,因此反应释放热量,属于放热反应。
ΔH的符号
放热反应中,ΔH = 生成物总能量 - 反应物总能量,故ΔH < 0。
第(2)题
键能关系分析
放热反应中,断裂旧化学键吸收的总能量 < 形成新化学键释放的总能量。因此,答案为“<”。
第(3)题
物质能量比较
反应物N₂和生成物CO的能量受反应条件(如高温)影响,且题目未提供键能数据,无法直接比较两者的能量高低。