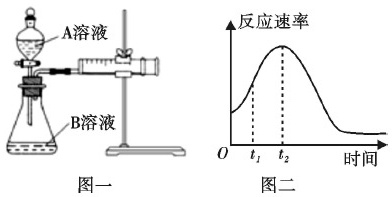
Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):实验序号A溶液B溶液①20mL 0.1mol·L-1H2C2O4溶液30mL 0.1 mol·L-1KMnO4溶液②20mL 0.2mol·L-1H2C2O4溶液30mL 0.1mol·L-1KMnO4溶液(1)该实验探究的是____因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。A溶液-|||-B溶液-|||-e-|||-反应速率-|||-0 t1 t2 时间-|||-图二-|||-图一(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)___ mol·L-1(假设混合液体积为50mL)。(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___来比较化学反应速率。(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_____。Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)A溶液-|||-B溶液-|||-e-|||-反应速率-|||-0 t1 t2 时间-|||-图二-|||-图一2NH3(g)。(1)下列描述能说明该可逆反应达到化学平衡状态的有___。A.容器内的压强不变B.容器内气体的密度不变C.相同时间内有3mol H-H键断裂,有6mol N-H键形成D.c(N2):c(H2):c(NH3)=1:3:2E.NH3的质量分数不再改变(2)若起始时向容器中充入10mol ·L-1的N2和15mol ·L-1的H2,10min时测得容器内NH3的浓度为1.5mol ·L-1。10min内用N2表示的反应速率为___;此时H2的转化率为___。13.除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:A溶液-|||-B溶液-|||-e-|||-反应速率-|||-0 t1 t2 时间-|||-图二-|||-图一下列有关说法中,不正确的是( )A.除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓B.试剂①一定不是Na2CO3溶液C.检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液D.滤液加稀盐酸时只发生反应:H+ +OH- =H2O14.下列事实中,不能用勒夏特列原理解释的是( )A.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率B.红棕色的NO2气体加压后颜色先变深再变浅C.在氨水中加入浓的氢氧化钠溶液,有氨气溢出D.合成氨工业用铁触媒作催化剂15.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(A溶液-|||-B溶液-|||-e-|||-反应速率-|||-0 t1 t2 时间-|||-图二-|||-图一)是最简单一种。下列关于该化合物的说法正确的是A.分子式为C5H8 B.一氯代物有两种同分异构体C.所有碳原子均处同一平面 D.与丙炔互为同系物16.根据元素周期表和元素周期律,判断下列叙述错误的是A.原子半径:K>Na>ClB.元素周期表有7个周期,18个族C.气态氢化物的稳定性: HF>H2O>PH3D.在周期表中金属与非金属分界处的硅是一种优良的半导体材料17.W、X、Y、Z是周期表中前20号的主族元素,原子序数依次增大。W、X、Y的原子最外层电子数之和为13,X与Z同主族,实验室可用Z的最高价氧化物的水化物稀溶液检验W的最高价氧化物。下列说法正确的是A.失去电子能力:X>Z>WB.原子半径:Z>Y>XC.W、X、Y、Z的最高正化合价依次为+4、+2、+7、+2D.W与Y形成的化合物含有极性键,不含有非极性键18.氢化铵(NH4H)与氯化铵的结构相似,它与水反应有气体生成。下列关于氢化铵叙述正确的是A.是离子化合物,含有离子键和共价键B.电子式是A溶液-|||-B溶液-|||-e-|||-反应速率-|||-0 t1 t2 时间-|||-图二-|||-图一C.与水反应时,NH4H是氧化剂D.固体投入少量的水中,只产生一种气体.
Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号
A溶液
B溶液
①
20mL 0.1mol·L-1H2C2O4溶液
30mL 0.1 mol·L-1KMnO4溶液
②
20mL 0.2mol·L-1H2C2O4溶液
30mL 0.1mol·L-1KMnO4溶液
(1)该实验探究的是____因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)___ mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_____。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:
N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(1)下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol ·L-1的N2和15mol ·L-1的H2,10min时测得容器内NH3的浓度为1.5mol ·L-1。10min内用N2表示的反应速率为___;此时H2的转化率为___。
13.除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:

下列有关说法中,不正确的是( )
A.除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B.试剂①一定不是Na2CO3溶液
C.检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D.滤液加稀盐酸时只发生反应:H+ +OH- =H2O
14.下列事实中,不能用勒夏特列原理解释的是( )
A.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率
B.红棕色的NO2气体加压后颜色先变深再变浅
C.在氨水中加入浓的氢氧化钠溶液,有氨气溢出
D.合成氨工业用铁触媒作催化剂
15.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(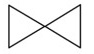 )是最简单一种。下列关于该化合物的说法正确的是
)是最简单一种。下列关于该化合物的说法正确的是
A.分子式为C5H8 B.一氯代物有两种同分异构体
C.所有碳原子均处同一平面 D.与丙炔互为同系物
16.根据元素周期表和元素周期律,判断下列叙述错误的是
A.原子半径:K>Na>Cl
B.元素周期表有7个周期,18个族
C.气态氢化物的稳定性: HF>H2O>PH3
D.在周期表中金属与非金属分界处的硅是一种优良的半导体材料
17.W、X、Y、Z是周期表中前20号的主族元素,原子序数依次增大。W、X、Y的原子最外层电子数之和为13,X与Z同主族,实验室可用Z的最高价氧化物的水化物稀溶液检验W的最高价氧化物。下列说法正确的是
A.失去电子能力:X>Z>W
B.原子半径:Z>Y>X
C.W、X、Y、Z的最高正化合价依次为+4、+2、+7、+2
D.W与Y形成的化合物含有极性键,不含有非极性键
18.氢化铵(NH4H)与氯化铵的结构相似,它与水反应有气体生成。下列关于氢化铵叙述正确的是
A.是离子化合物,含有离子键和共价键
B.电子式是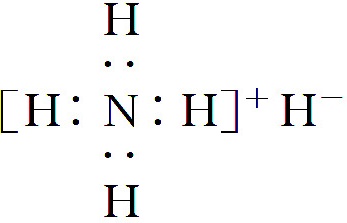
C.与水反应时,NH4H是氧化剂
D.固体投入少量的水中,只产生一种气体
.题目解答
答案
[答案]浓度 ②>① 0.0596mol/L 测定生成相同体积的CO2所需时间或相同时间内KMnO4溶液颜色变化的程度 该反应放热 AE 0.075mol/( L·min) 15%
.