题目
11.某水溶液是含有非挥发性溶质的稀薄溶液,在271.7K时凝固(固相为纯-|||-的固态溶剂)。求该溶液的:-|||-(1)正常沸点;-|||-(2)298.2K时的蒸气压(该温度下,纯水的蒸气压为3.167kPa );-|||-(3)298.2K时的渗透压。

题目解答
答案
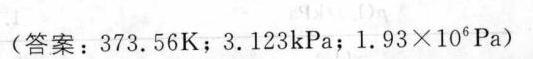
解析
步骤 1:计算溶液的凝固点降低
根据凝固点降低公式 $\Delta T_f = K_f \cdot m$,其中 $\Delta T_f$ 是凝固点降低,$K_f$ 是溶剂的凝固点降低常数,$m$ 是溶液的摩尔浓度。对于水,$K_f = 1.86 K \cdot kg \cdot mol^{-1}$。已知溶液在271.7K时凝固,纯水的凝固点为273.15K,所以 $\Delta T_f = 273.15K - 271.7K = 1.45K$。由此可以计算出溶液的摩尔浓度 $m$。
步骤 2:计算溶液的正常沸点
根据沸点升高公式 $\Delta T_b = K_b \cdot m$,其中 $\Delta T_b$ 是沸点升高,$K_b$ 是溶剂的沸点升高常数,$m$ 是溶液的摩尔浓度。对于水,$K_b = 0.512 K \cdot kg \cdot mol^{-1}$。已知纯水的沸点为373.15K,可以计算出溶液的正常沸点。
步骤 3:计算溶液在298.2K时的蒸气压
根据拉乌尔定律,溶液的蒸气压 $P = P^0 \cdot x$,其中 $P^0$ 是纯溶剂的蒸气压,$x$ 是溶剂的摩尔分数。已知纯水在298.2K时的蒸气压为3.167kPa,可以计算出溶液的蒸气压。
步骤 4:计算溶液在298.2K时的渗透压
根据渗透压公式 $\Pi = i \cdot c \cdot R \cdot T$,其中 $\Pi$ 是渗透压,$i$ 是溶质的解离系数,$c$ 是溶质的摩尔浓度,$R$ 是理想气体常数,$T$ 是绝对温度。已知 $i = 1$,$c = m$,$R = 8.314 J \cdot mol^{-1} \cdot K^{-1}$,$T = 298.2K$,可以计算出溶液的渗透压。
根据凝固点降低公式 $\Delta T_f = K_f \cdot m$,其中 $\Delta T_f$ 是凝固点降低,$K_f$ 是溶剂的凝固点降低常数,$m$ 是溶液的摩尔浓度。对于水,$K_f = 1.86 K \cdot kg \cdot mol^{-1}$。已知溶液在271.7K时凝固,纯水的凝固点为273.15K,所以 $\Delta T_f = 273.15K - 271.7K = 1.45K$。由此可以计算出溶液的摩尔浓度 $m$。
步骤 2:计算溶液的正常沸点
根据沸点升高公式 $\Delta T_b = K_b \cdot m$,其中 $\Delta T_b$ 是沸点升高,$K_b$ 是溶剂的沸点升高常数,$m$ 是溶液的摩尔浓度。对于水,$K_b = 0.512 K \cdot kg \cdot mol^{-1}$。已知纯水的沸点为373.15K,可以计算出溶液的正常沸点。
步骤 3:计算溶液在298.2K时的蒸气压
根据拉乌尔定律,溶液的蒸气压 $P = P^0 \cdot x$,其中 $P^0$ 是纯溶剂的蒸气压,$x$ 是溶剂的摩尔分数。已知纯水在298.2K时的蒸气压为3.167kPa,可以计算出溶液的蒸气压。
步骤 4:计算溶液在298.2K时的渗透压
根据渗透压公式 $\Pi = i \cdot c \cdot R \cdot T$,其中 $\Pi$ 是渗透压,$i$ 是溶质的解离系数,$c$ 是溶质的摩尔浓度,$R$ 是理想气体常数,$T$ 是绝对温度。已知 $i = 1$,$c = m$,$R = 8.314 J \cdot mol^{-1} \cdot K^{-1}$,$T = 298.2K$,可以计算出溶液的渗透压。