反应式 C(s) + CO2(g)2CO(g) 已知:767℃ = 4.61, 667℃ = 0.500问:(1) 这个反应是吸热反应还是放热反应? 为什么?(2) 667℃时是多少? (3) 此反应的是多少? (4) 此反应的是多少?
反应式 C(s) + CO2(g)2CO(g) 已知:767℃ = 4.61, 667℃ = 0.500
问:(1) 这个反应是吸热反应还是放热反应? 为什么?
(2) 667℃时是多少? (3) 此反应的是多少? (4) 此反应的是多少?
题目解答
答案
解:(1) 吸热反应,因T增加,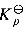 值增加。
值增加。
(2) 在940 K时,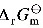 = -2.303RT lg
= -2.303RT lg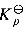 = -2.303 0.008314 940 lg0.500 = 5.41(kJ·mol-1)
= -2.303 0.008314 940 lg0.500 = 5.41(kJ·mol-1)
(3)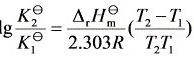
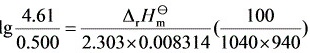
 = 180.58 kJ·mol-1
= 180.58 kJ·mol-1
(4) 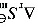 =
=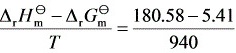 = 0.186 (kJ·mol-1·K-1)
= 0.186 (kJ·mol-1·K-1)
解析
考查要点:本题主要考查化学平衡中的热力学判断及计算,涉及平衡常数与温度的关系、标准摩尔吉布斯自由能变、焓变、熵变的计算。
解题核心思路:
- 判断反应吸放热:根据平衡常数随温度变化的趋势,结合范特霍夫方程的定性分析。
- 计算ΔG°:利用公式 $\Delta G^\theta = -RT \ln K$。
- 计算ΔH°:通过两个温度下的平衡常数,应用范特霍夫方程的线性形式。
- 计算ΔS°:结合吉布斯方程 $\Delta G^\theta = \Delta H^\theta - T\Delta S^\theta$。
破题关键点:
- 平衡常数与温度关系:若温度升高,平衡常数增大,则反应为吸热(ΔH°>0)。
- 公式变形与单位统一:温度需转换为开尔文(K),常数R取0.008314 kJ·mol⁻¹·K⁻¹。
第(1)题
判断反应吸放热
当温度从667℃(940 K)升至767℃(1040 K)时,平衡常数K从0.500增加到4.61。平衡常数随温度升高而增大,说明正反应为吸热反应(升温有利于生成物,K增大)。
第(2)题
计算ΔG°(667℃)
公式代入
$\Delta G^\theta = -RT \ln K$
其中 $R=0.008314 \, \text{kJ·mol}^{-1}\text{·K}^{-1}$,$T=940 \, \text{K}$,$K=0.500$。
计算过程
$\Delta G^\theta = -0.008314 \times 940 \times \ln 0.500 \approx 5.41 \, \text{kJ·mol}^{-1}$
第(3)题
计算ΔH°
范特霍夫方程线性形式
$\ln \frac{K_2}{K_1} = \frac{\Delta H^\theta}{R} \left( \frac{1}{T_1} - \frac{1}{T_2} \right)$
代入数据
$\ln \frac{4.61}{0.500} = \frac{\Delta H^\theta}{0.008314} \left( \frac{1}{940} - \frac{1}{1040} \right)$
解方程
$\Delta H^\theta \approx 180.58 \, \text{kJ·mol}^{-1}$
第(4)题
计算ΔS°
吉布斯方程变形
$\Delta S^\theta = \frac{\Delta H^\theta - \Delta G^\theta}{T}$
代入数据
$\Delta S^\theta = \frac{180.58 - 5.41}{940} \approx 0.186 \, \text{kJ·mol}^{-1}\text{·K}^{-1}$