题目
在一个体积恒定为2m^3, '=0 的绝热反应器中发生某化学反应,使系-|||-统温度升高1200℃,压力增加300kPa,此过程的 Delta U= () ; Delta H= () 。

题目解答
答案
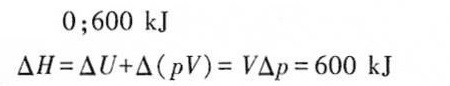
解析
步骤 1:确定过程的类型
题目中提到反应器是绝热的,且体积恒定,这意味着没有热量交换(Q=0)和体积功(W'=0)。
步骤 2:计算内能变化 $\Delta U$
由于过程是绝热的,且没有体积功,根据热力学第一定律,$\Delta U = Q + W'$,可以得出 $\Delta U = 0$。
步骤 3:计算焓变 $\Delta H$
焓变 $\Delta H$ 可以通过 $\Delta H = \Delta U + \Delta (pV)$ 来计算。由于体积恒定,$\Delta (pV) = V\Delta P$。将已知的体积和压力变化代入,得到 $\Delta H = 2m^3 \times 300kPa = 600kJ$。
题目中提到反应器是绝热的,且体积恒定,这意味着没有热量交换(Q=0)和体积功(W'=0)。
步骤 2:计算内能变化 $\Delta U$
由于过程是绝热的,且没有体积功,根据热力学第一定律,$\Delta U = Q + W'$,可以得出 $\Delta U = 0$。
步骤 3:计算焓变 $\Delta H$
焓变 $\Delta H$ 可以通过 $\Delta H = \Delta U + \Delta (pV)$ 来计算。由于体积恒定,$\Delta (pV) = V\Delta P$。将已知的体积和压力变化代入,得到 $\Delta H = 2m^3 \times 300kPa = 600kJ$。