题目
7.用配位滴定法测定氯化锌(ZnCl2)的含量。称取0.2500g试样,溶于水后,稀释至-|||-250mL,吸取25.00 mL,在 pH=5~6 时,用二甲酚橙作指示剂,用 .01024molcdot (L)^-1 EDTA-|||-标准溶液滴定,用去17.61mL。计算试样中含ZnCl2的质量分数。

题目解答
答案
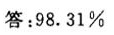
解析
步骤 1:计算EDTA标准溶液滴定的摩尔数
根据公式 $n = c \times V$,其中 $c$ 是浓度,$V$ 是体积,可以计算出EDTA标准溶液滴定的摩尔数。
步骤 2:计算ZnCl2的摩尔数
由于EDTA与ZnCl2的反应比例为1:1,所以EDTA标准溶液滴定的摩尔数等于ZnCl2的摩尔数。
步骤 3:计算ZnCl2的质量
根据公式 $m = n \times M$,其中 $n$ 是摩尔数,$M$ 是摩尔质量,可以计算出ZnCl2的质量。
步骤 4:计算ZnCl2的质量分数
根据公式 $\omega = \frac{m_{ZnCl2}}{m_{试样}} \times 100\%$,其中 $m_{ZnCl2}$ 是ZnCl2的质量,$m_{试样}$ 是试样的质量,可以计算出ZnCl2的质量分数。
根据公式 $n = c \times V$,其中 $c$ 是浓度,$V$ 是体积,可以计算出EDTA标准溶液滴定的摩尔数。
步骤 2:计算ZnCl2的摩尔数
由于EDTA与ZnCl2的反应比例为1:1,所以EDTA标准溶液滴定的摩尔数等于ZnCl2的摩尔数。
步骤 3:计算ZnCl2的质量
根据公式 $m = n \times M$,其中 $n$ 是摩尔数,$M$ 是摩尔质量,可以计算出ZnCl2的质量。
步骤 4:计算ZnCl2的质量分数
根据公式 $\omega = \frac{m_{ZnCl2}}{m_{试样}} \times 100\%$,其中 $m_{ZnCl2}$ 是ZnCl2的质量,$m_{试样}$ 是试样的质量,可以计算出ZnCl2的质量分数。