题目
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 ____ (填化学式)的排放量。(2)图1为元素周期表中的一格,下列说法不正确的是 ____ (填标号)。A.碳元素属于非金属元素B.碳原子核内质子数为6C.碳元素的原子结构示意图为D.碳的相对原子质量为12.01(3)甲、乙、丙、丁是初中化学常见的化合物,甲和乙中含有碳元素,丙能做干燥剂。它们之间有如图2所示的转化关系(部分物质和反应条件已略去)。则甲的化学式为 ____ ;丙转化为丁的化学方程式为 ____ (4)图3是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。请分析其原因,并写出化学方程式 ____ 。(5)利用如图装置可做CO还原Fe2O3,的实验,并检验该反应生成的气体产物。已知由A装置制取的CO气体中混有少量的CO2。①CO与Fe2O3反应的化学方程式为 ____ 。②气体通过装置的顺序是A→ ____ (装置不能重复使用)。③从环保角度考虑,对以上装置的改进措施是 ____ 。(6)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算石灰石中杂质的质量分数。
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 ____ (填化学式)的排放量。
(2)图1为元素周期表中的一格,下列说法不正确的是 ____ (填标号)。
A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为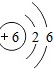
D.碳的相对原子质量为12.01
(3)甲、乙、丙、丁是初中化学常见的化合物,甲和乙中含有碳元素,丙能做干燥剂。它们之间有如图2所示的转化关系(部分物质和反应条件已略去)。则甲的化学式为 ____ ;丙转化为丁的化学方程式为 ____
(4)图3是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。请分析其原因,并写出化学方程式 ____ 。
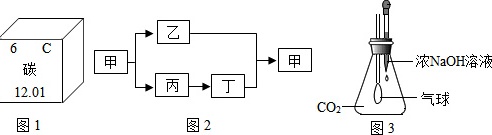
(5)利用如图装置可做CO还原Fe2O3,的实验,并检验该反应生成的气体产物。已知由A装置制取的CO气体中混有少量的CO2。
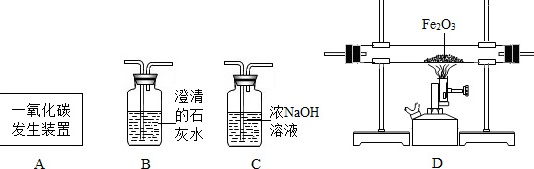
①CO与Fe2O3反应的化学方程式为 ____ 。
②气体通过装置的顺序是A→ ____ (装置不能重复使用)。
③从环保角度考虑,对以上装置的改进措施是 ____ 。
(6)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算石灰石中杂质的质量分数。
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 ____ (填化学式)的排放量。
(2)图1为元素周期表中的一格,下列说法不正确的是 ____ (填标号)。
A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为
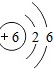
D.碳的相对原子质量为12.01
(3)甲、乙、丙、丁是初中化学常见的化合物,甲和乙中含有碳元素,丙能做干燥剂。它们之间有如图2所示的转化关系(部分物质和反应条件已略去)。则甲的化学式为 ____ ;丙转化为丁的化学方程式为 ____
(4)图3是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。请分析其原因,并写出化学方程式 ____ 。

(5)利用如图装置可做CO还原Fe2O3,的实验,并检验该反应生成的气体产物。已知由A装置制取的CO气体中混有少量的CO2。

①CO与Fe2O3反应的化学方程式为 ____ 。
②气体通过装置的顺序是A→ ____ (装置不能重复使用)。
③从环保角度考虑,对以上装置的改进措施是 ____ 。
(6)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算石灰石中杂质的质量分数。
题目解答
答案
解:(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 二氧化碳的排放;
(2)碳原子核外最外层应为4个电子,故C错误;
(3)甲和乙中含有碳元素,丙能做干燥剂,常见的干燥剂是氧化钙、氢氧化钠、浓硫酸;甲分解产生乙和丙,故丙是氧化钙,甲是碳酸钙,乙是二氧化碳,丁是氧化钙与水化合生成的氢氧化钙;
(4)CO2被浓NaOH溶液吸收,锥形瓶内的气压成小,外界大气压大于锥形瓶内的气压,使气球胀大。 化学方程式为 2NaOH+CO2=Na2CO3+H2O
(5)CO与Fe2O3反应生成铁和二氧化碳,化学方程式为 Fe2O3+3C0$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 检验二氧化碳应用澄清石灰水,故顺序为C→D→B 一氧化碳有毒,排放到空气中会污染空气,故应将尾气点燃或进行收集处理。
(6)反应前后烧杯内质量的减少量即为生成的二氧化碳的质量,根据化学方程式中二氧化碳的质量可求出碳酸钙的质量,进而求出杂质的质量分数。
故答案为:(1)CO2 (2)C
(3)CaCO3 CaO+H2O=Ca(OH)2
(4)CO2被浓NaOH溶液吸收,锥形瓶内的气压成小,外界大气压大于锥形瓶内的气压,使气球胀大。 2NaOH+CO2=Na2CO3+H2O
(5)①Fe2O3+3C0$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 ②C→D→B
③将尾气点燃或进行收集等。
(6)解:生成CO2的质量为:12.5 g+50 g-58.1g=4.4g
设石灰石中CaCO3的质量为x。
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 4.4g
$\frac{100}{44}=\frac{x}{4.4g}$,x=10g
石灰石中杂质的质量分数为:
$\frac{12.5g-10g}{12.5g}$×100%=20%
答:石灰石中杂质的质量分数为20%。
(2)碳原子核外最外层应为4个电子,故C错误;
(3)甲和乙中含有碳元素,丙能做干燥剂,常见的干燥剂是氧化钙、氢氧化钠、浓硫酸;甲分解产生乙和丙,故丙是氧化钙,甲是碳酸钙,乙是二氧化碳,丁是氧化钙与水化合生成的氢氧化钙;
(4)CO2被浓NaOH溶液吸收,锥形瓶内的气压成小,外界大气压大于锥形瓶内的气压,使气球胀大。 化学方程式为 2NaOH+CO2=Na2CO3+H2O
(5)CO与Fe2O3反应生成铁和二氧化碳,化学方程式为 Fe2O3+3C0$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 检验二氧化碳应用澄清石灰水,故顺序为C→D→B 一氧化碳有毒,排放到空气中会污染空气,故应将尾气点燃或进行收集处理。
(6)反应前后烧杯内质量的减少量即为生成的二氧化碳的质量,根据化学方程式中二氧化碳的质量可求出碳酸钙的质量,进而求出杂质的质量分数。
故答案为:(1)CO2 (2)C
(3)CaCO3 CaO+H2O=Ca(OH)2
(4)CO2被浓NaOH溶液吸收,锥形瓶内的气压成小,外界大气压大于锥形瓶内的气压,使气球胀大。 2NaOH+CO2=Na2CO3+H2O
(5)①Fe2O3+3C0$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 ②C→D→B
③将尾气点燃或进行收集等。
(6)解:生成CO2的质量为:12.5 g+50 g-58.1g=4.4g
设石灰石中CaCO3的质量为x。
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 4.4g
$\frac{100}{44}=\frac{x}{4.4g}$,x=10g
石灰石中杂质的质量分数为:
$\frac{12.5g-10g}{12.5g}$×100%=20%
答:石灰石中杂质的质量分数为20%。