题目
三水合硝酸铜[Cu(NO3)2•3H2O,M=242g•mol-1]是一种重要的无机试剂,常用作搪瓷着色剂,也用于镀铜、制氧化铜及农药等。回答下列问题:Ⅰ.三水合硝酸铜[Cu(NO3)2•3H20]的制备。实验室常用废铜屑与稀硝酸反应制备硝酸铜溶液,过滤出剩余铜屑,再经蒸发浓缩、冷却结晶、过滤、乙醇洗涤后得到三水合硝酸铜晶体。(1)制备硝酸铜时发生反应的离子方程式为 ____ 。(2)若废铜屑中含有杂质铁,则检验所得硝酸铜溶液中含有铁元素的方法为 ____ 。Ⅱ.Cu(NO3)2溶液的配制。(3)实验室里需要500mL0.1mol•L-1Cu(NO3)2溶液。用三水合硝酸铜[Cu(NO3)2•3H20]配制该溶液时,下列仪器一定不需要的是 ____ (填仪器名称)。C-|||-25℃ 25℃-|||-100 500mL-|||-A B C D E F(4)所需三水合硝酸铜固体的质量为 ____ g。(5)配制过程中,下列操作将导致溶液浓度偏小的是 ____ (填序号)。A.加水定容时俯视刻度线B.容量瓶未干燥处理C.定容加水时超过刻度线后,立即吸出多余的水D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯Ⅲ.三水合硝酸铜[Cu(NO3)2•3H20]热分解实验。(6)将24.2gCu(NO3)2•3H20样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在T1℃∼T2℃过程中有红棕色气体产生,反应的化学方程式为 ____ 。继续升温至T3℃时生成的固体产物为 ____ (填化学式)。C-|||-25℃ 25℃-|||-100 500mL-|||-A B C D E F
三水合硝酸铜[Cu(NO3)2•3H2O,M=242g•mol-1]是一种重要的无机试剂,常用作搪瓷着色剂,也用于镀铜、制氧化铜及农药等。回答下列问题:
Ⅰ.三水合硝酸铜[Cu(NO3)2•3H20]的制备。
实验室常用废铜屑与稀硝酸反应制备硝酸铜溶液,过滤出剩余铜屑,再经蒸发浓缩、冷却结晶、过滤、乙醇洗涤后得到三水合硝酸铜晶体。
(1)制备硝酸铜时发生反应的离子方程式为 ____ 。
(2)若废铜屑中含有杂质铁,则检验所得硝酸铜溶液中含有铁元素的方法为 ____ 。
Ⅱ.Cu(NO3)2溶液的配制。
(3)实验室里需要500mL0.1mol•L-1Cu(NO3)2溶液。用三水合硝酸铜[Cu(NO3)2•3H20]配制该溶液时,下列仪器一定不需要的是 ____ (填仪器名称)。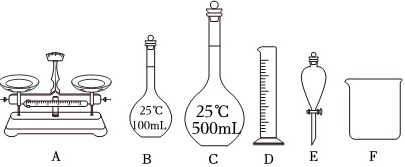
(4)所需三水合硝酸铜固体的质量为 ____ g。
(5)配制过程中,下列操作将导致溶液浓度偏小的是 ____ (填序号)。
A.加水定容时俯视刻度线
B.容量瓶未干燥处理
C.定容加水时超过刻度线后,立即吸出多余的水
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
Ⅲ.三水合硝酸铜[Cu(NO3)2•3H20]热分解实验。
(6)将24.2gCu(NO3)2•3H20样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在T1℃∼T2℃过程中有红棕色气体产生,反应的化学方程式为 ____ 。继续升温至T3℃时生成的固体产物为 ____ (填化学式)。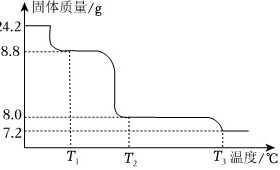
Ⅰ.三水合硝酸铜[Cu(NO3)2•3H20]的制备。
实验室常用废铜屑与稀硝酸反应制备硝酸铜溶液,过滤出剩余铜屑,再经蒸发浓缩、冷却结晶、过滤、乙醇洗涤后得到三水合硝酸铜晶体。
(1)制备硝酸铜时发生反应的离子方程式为 ____ 。
(2)若废铜屑中含有杂质铁,则检验所得硝酸铜溶液中含有铁元素的方法为 ____ 。
Ⅱ.Cu(NO3)2溶液的配制。
(3)实验室里需要500mL0.1mol•L-1Cu(NO3)2溶液。用三水合硝酸铜[Cu(NO3)2•3H20]配制该溶液时,下列仪器一定不需要的是 ____ (填仪器名称)。

(4)所需三水合硝酸铜固体的质量为 ____ g。
(5)配制过程中,下列操作将导致溶液浓度偏小的是 ____ (填序号)。
A.加水定容时俯视刻度线
B.容量瓶未干燥处理
C.定容加水时超过刻度线后,立即吸出多余的水
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
Ⅲ.三水合硝酸铜[Cu(NO3)2•3H20]热分解实验。
(6)将24.2gCu(NO3)2•3H20样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在T1℃∼T2℃过程中有红棕色气体产生,反应的化学方程式为 ____ 。继续升温至T3℃时生成的固体产物为 ____ (填化学式)。

题目解答
答案
解:(1)制备硝酸铜时,铜和硝酸反应生成硝酸铜、一氧化氮、水,发生反应的离子方程式为$3Cu+8{H}^{+}+2N{O}_{3}^{-}=3C{u}^{2+}+2NO↑+4{H}_{2}O$,
故答案为:$3Cu+8{H}^{+}+2N{O}_{3}^{-}=3C{u}^{2+}+2NO↑+4{H}_{2}O$;
(2)若废铜屑中含有杂质铁,反应后有铜剩余,说明溶液中的铁元素以Fe2+的形式存在,则检验所得硝酸铜溶液中含有铁元素的方法为取少些实验所得硝酸铜溶液,加入铁氰化钾深激,若有蓝色沉淀产生,则溶液中含有铁元素,
故答案为:取少量实验所得硝酸铜溶液,加入铁氰化钾溶液,若有蓝色沉淀产生,则溶液中含有铁元素(或取少量实验所得硝酸铜溶液,先加入硝酸,然后加入KSCN溶液,若溶液变为红色,则溶液中含有铁元素);
(3)实验室里需要500mL0.1mol•L-1Cu(NO3)2溶液,操作步骤有:计算、称量、溶解(并冷却)、移液、洗涤、定容,摇匀,配制时需要500mL规格的容量瓶、胶头滴管、烧杯、玻璃棒、托盘天平,因此不需要的仪器有100mL容量瓶和分液漏斗,
故答案为:100mL容量瓶、分液漏斗;
(4)用500mL容量瓶配制0.1mol•L-1Cu(NO3)2溶液,需要0.05molCu(NO3)2⋅3H2O,质量为0.05mol×242g⋅mol-1=12.1g,
故答案为:12.1;
(5)A.配制过程中,加水定容时俯视刻度线,溶液体积偏小,会导致浓度偏大,故A错误;
B.容量瓶未干燥处理,对溶液的浓度无影响,故B错误;
C.定容加水时超过刻度线后,立即吸出多余的水,会导致溶质减少,浓度偏低,故C正确;
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯,会导致溶质减少,浓度偏低,故D错误;
故答案为:CD;
(6)24.2gCu(NO3)2•3H2O的物质的量为0.1mol,完全失去结晶水生成0.1mol Cu(NO3)2,质量为18.8g,根据铜元素守恒,Cu(NO3)2分解生成0.1mol氧化铜,质量为8g,再加热生成0.05molCu2O,质量为7.2g,T1℃的固体产物是Cu(NO3)2,T2℃的固体产物是CuO,T3℃的固体产物是Cu2O,T1℃~T2℃时固体由Cu(NO3)2转化为CuO,同时观察到有NO2逸出,根据氧化还原反应规律,同时还有氧气生成,因此T1℃~T2℃Cu(NO3)2分解产物为CuO、NO2、O2,反应的化学方程式为$2Cu{(N{O}_{3})}_{2}\underline{\underline{\;\;\;△\;\;\;}}2CuO+4N{O}_{2}↑+{O}_{2}↑$,加热到T2℃时CuO又分解,最终生成Cu2O,
故答案为:$2Cu{(N{O}_{3})}_{2}\frac{\underline{\;△\;}}{\;}2CuO+4N{O}_{2}↑+{O}_{2}↑$;Cu2O。
故答案为:$3Cu+8{H}^{+}+2N{O}_{3}^{-}=3C{u}^{2+}+2NO↑+4{H}_{2}O$;
(2)若废铜屑中含有杂质铁,反应后有铜剩余,说明溶液中的铁元素以Fe2+的形式存在,则检验所得硝酸铜溶液中含有铁元素的方法为取少些实验所得硝酸铜溶液,加入铁氰化钾深激,若有蓝色沉淀产生,则溶液中含有铁元素,
故答案为:取少量实验所得硝酸铜溶液,加入铁氰化钾溶液,若有蓝色沉淀产生,则溶液中含有铁元素(或取少量实验所得硝酸铜溶液,先加入硝酸,然后加入KSCN溶液,若溶液变为红色,则溶液中含有铁元素);
(3)实验室里需要500mL0.1mol•L-1Cu(NO3)2溶液,操作步骤有:计算、称量、溶解(并冷却)、移液、洗涤、定容,摇匀,配制时需要500mL规格的容量瓶、胶头滴管、烧杯、玻璃棒、托盘天平,因此不需要的仪器有100mL容量瓶和分液漏斗,
故答案为:100mL容量瓶、分液漏斗;
(4)用500mL容量瓶配制0.1mol•L-1Cu(NO3)2溶液,需要0.05molCu(NO3)2⋅3H2O,质量为0.05mol×242g⋅mol-1=12.1g,
故答案为:12.1;
(5)A.配制过程中,加水定容时俯视刻度线,溶液体积偏小,会导致浓度偏大,故A错误;
B.容量瓶未干燥处理,对溶液的浓度无影响,故B错误;
C.定容加水时超过刻度线后,立即吸出多余的水,会导致溶质减少,浓度偏低,故C正确;
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯,会导致溶质减少,浓度偏低,故D错误;
故答案为:CD;
(6)24.2gCu(NO3)2•3H2O的物质的量为0.1mol,完全失去结晶水生成0.1mol Cu(NO3)2,质量为18.8g,根据铜元素守恒,Cu(NO3)2分解生成0.1mol氧化铜,质量为8g,再加热生成0.05molCu2O,质量为7.2g,T1℃的固体产物是Cu(NO3)2,T2℃的固体产物是CuO,T3℃的固体产物是Cu2O,T1℃~T2℃时固体由Cu(NO3)2转化为CuO,同时观察到有NO2逸出,根据氧化还原反应规律,同时还有氧气生成,因此T1℃~T2℃Cu(NO3)2分解产物为CuO、NO2、O2,反应的化学方程式为$2Cu{(N{O}_{3})}_{2}\underline{\underline{\;\;\;△\;\;\;}}2CuO+4N{O}_{2}↑+{O}_{2}↑$,加热到T2℃时CuO又分解,最终生成Cu2O,
故答案为:$2Cu{(N{O}_{3})}_{2}\frac{\underline{\;△\;}}{\;}2CuO+4N{O}_{2}↑+{O}_{2}↑$;Cu2O。