题目
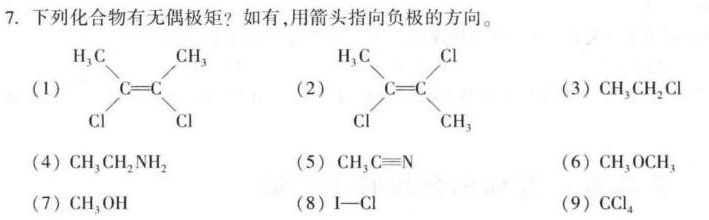
7.下列化合物有无偶极矩?如有,用箭头指向负极的方向。-|||-CH3-|||-(1) C=C-|||-Cl-|||-H3C Cl-|||-(2) C=C-|||-Cl CH3-|||-(3)CH3CH2Cl-|||-(4)CH3CH2 NH2-|||-(5) (H)_(3)C=N-|||-(6)CH3OCH3-|||-(7)CH3OH-|||-(8) https:/img.zuoyebang.cc/zyb_64ff51ec0d1ce37ebfba22293852539d.jpg-C1-|||-(9)CCl4
题目解答
答案
解析
步骤 1:理解偶极矩的概念
偶极矩是描述分子中正负电荷中心不重合时,分子的极性大小的物理量。如果分子中正负电荷中心重合,则分子没有偶极矩。
步骤 2:分析每个化合物的结构
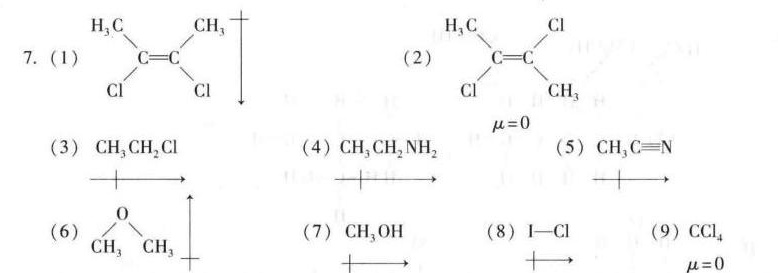
(1) H3C-CH3:这是一个对称的分子,正负电荷中心重合,因此没有偶极矩。
(2) H3C-Cl:这是一个不对称的分子,氯原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氯原子。
(3) CH3-CH2-Cl:这是一个不对称的分子,氯原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氯原子。
(4) CH3-CH2-NH2:这是一个不对称的分子,氮原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氮原子。
(5) CH3-C≡N:这是一个不对称的分子,氮原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氮原子。
(6) CH3-O-CH3:这是一个对称的分子,正负电荷中心重合,因此没有偶极矩。
(7) CH3-OH:这是一个不对称的分子,氧原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氧原子。
(8) I-Cl:这是一个不对称的分子,氯原子的电负性比碘原子大,因此分子有偶极矩,箭头指向氯原子。
(9) CCl4:这是一个对称的分子,正负电荷中心重合,因此没有偶极矩。
步骤 3:总结每个化合物的偶极矩情况
根据上述分析,我们可以得出每个化合物的偶极矩情况。
偶极矩是描述分子中正负电荷中心不重合时,分子的极性大小的物理量。如果分子中正负电荷中心重合,则分子没有偶极矩。
步骤 2:分析每个化合物的结构
(1) H3C-CH3:这是一个对称的分子,正负电荷中心重合,因此没有偶极矩。
(2) H3C-Cl:这是一个不对称的分子,氯原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氯原子。
(3) CH3-CH2-Cl:这是一个不对称的分子,氯原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氯原子。
(4) CH3-CH2-NH2:这是一个不对称的分子,氮原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氮原子。
(5) CH3-C≡N:这是一个不对称的分子,氮原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氮原子。
(6) CH3-O-CH3:这是一个对称的分子,正负电荷中心重合,因此没有偶极矩。
(7) CH3-OH:这是一个不对称的分子,氧原子的电负性比碳原子大,因此分子有偶极矩,箭头指向氧原子。
(8) I-Cl:这是一个不对称的分子,氯原子的电负性比碘原子大,因此分子有偶极矩,箭头指向氯原子。
(9) CCl4:这是一个对称的分子,正负电荷中心重合,因此没有偶极矩。
步骤 3:总结每个化合物的偶极矩情况
根据上述分析,我们可以得出每个化合物的偶极矩情况。