题目
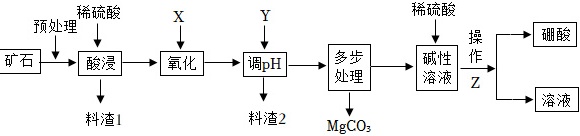
硼酸(H3BO3)能溶于水,可用于玻璃、医药、纺织等工业。碳酸镁可用于制造防火涂料、牙膏等。某工厂以硼镁铁矿(主要成分为Mg2B2O5•H2O,杂质有SiO2、FeO、Fe2O3、Al2O3)为原料制备硼酸、碳酸镁的工艺流程如如图所示:稀硫酸 x Y 稀硫酸-|||-预处理 ↓-|||-+-|||-矿石 + 酸浸 氧化 调pH 多步 碱性 操 硼酸-|||-处理 溶液 Z-|||-+ 溶液-|||-料渣1 料渣2 MgCO3已知:①常温时实验条件下几种金属离子形成沉淀的pH如下表;②SiO2不溶于水,也不与酸反应;③硼酸各温度下的的溶解度如下表。硼酸的溶解度 温度/℃ 溶解度,g/100g 温度,℃ 溶解度,g/100g 0 2.77 40 8.90 10 3.65 50 11.39 20 4.87 60 14.89 25 5.74 80 23.54 30 6.77 100 38.00 开始沉淀 完全沉淀 Fe3+ 2.7 3.2 Fe2+ 7.6 9.6 Al3+ 4.0 5.2 Mg2+ 9.6 11.1 (1)预处理的内容包括矿石的筛选、 ____ ,写出料渣1的化学式 ____ 。(2)酸浸时Mg2B2O5•H2O与硫酸反应生成硫酸镁和硼酸,写出化学方程式 ____ ;氧化过程的化学方程式为:X+H2SO4+2FeSO4=Fe2(SO4)3+2H2O。X化学式是 ____ ,X作氧化剂的优点 ____ 。(3)为提高产品纯度,控制的pH范围是 ____ ;试剂Y为 ____ (填选项)。A.MgOB.Fe2O3C.Fe(OH)3D.Mg(OH)2(4)为测量所得硼酸纯度,取3.00g制取的硼酸样品溶于甘露醇与蒸馏水混合溶液中配成500mL溶液,取出25.00mL放入锥形瓶并滴加3滴酚酞试液,用0.004g/mLNaOH标准溶液进行中和滴定,滴定终点时消耗22.00mL标准溶液。则滴定终点时的现象是 ____ ,样品中硼酸的纯度是 ____ ?(请写出计算过程,小数点后保留一位有效数字,中和反应的化学方程式为H3BO3+NaOH═NaH2BO3+H2O)。(5)操作Z包括: ____ 、 ____ 、过滤、洗涤、干燥。(6)此工艺流程中提高硼酸产率措施有: ____ 、 ____ ……
硼酸(H3BO3)能溶于水,可用于玻璃、医药、纺织等工业。碳酸镁可用于制造防火涂料、牙膏等。某工厂以硼镁铁矿(主要成分为Mg2B2O5•H2O,杂质有SiO2、FeO、Fe2O3、Al2O3)为原料制备硼酸、碳酸镁的工艺流程如如图所示:
已知:①常温时实验条件下几种金属离子形成沉淀的pH如下表;
②SiO2不溶于水,也不与酸反应;
③硼酸各温度下的的溶解度如下表。
硼酸的溶解度
(1)预处理的内容包括矿石的筛选、 ____ ,写出料渣1的化学式 ____ 。
(2)酸浸时Mg2B2O5•H2O与硫酸反应生成硫酸镁和硼酸,写出化学方程式 ____ ;氧化过程的化学方程式为:X+H2SO4+2FeSO4=Fe2(SO4)3+2H2O。X化学式是 ____ ,X作氧化剂的优点 ____ 。
(3)为提高产品纯度,控制的pH范围是 ____ ;试剂Y为 ____ (填选项)。
A.MgO
B.Fe2O3
C.Fe(OH)3
D.Mg(OH)2
(4)为测量所得硼酸纯度,取3.00g制取的硼酸样品溶于甘露醇与蒸馏水混合溶液中配成500mL溶液,取出25.00mL放入锥形瓶并滴加3滴酚酞试液,用0.004g/mLNaOH标准溶液进行中和滴定,滴定终点时消耗22.00mL标准溶液。则滴定终点时的现象是 ____ ,样品中硼酸的纯度是 ____ ?(请写出计算过程,小数点后保留一位有效数字,中和反应的化学方程式为H3BO3+NaOH═NaH2BO3+H2O)。
(5)操作Z包括: ____ 、 ____ 、过滤、洗涤、干燥。
(6)此工艺流程中提高硼酸产率措施有: ____ 、 ____ ……

已知:①常温时实验条件下几种金属离子形成沉淀的pH如下表;
②SiO2不溶于水,也不与酸反应;
③硼酸各温度下的的溶解度如下表。
硼酸的溶解度
| 温度/℃ | 溶解度,g/100g | 温度,℃ | 溶解度,g/100g | |||
| 0 | 2.77 | 40 | 8.90 | |||
| 10 | 3.65 | 50 | 11.39 | |||
| 20 | 4.87 | 60 | 14.89 | |||
| 25 | 5.74 | 80 | 23.54 | |||
| 30 | 6.77 | 100 | 38.00 | |||
| 开始沉淀 | 完全沉淀 | |||||
| Fe3+ | 2.7 | 3.2 | ||||
| Fe2+ | 7.6 | 9.6 | ||||
| Al3+ | 4.0 | 5.2 | ||||
| Mg2+ | 9.6 | 11.1 | ||||
(2)酸浸时Mg2B2O5•H2O与硫酸反应生成硫酸镁和硼酸,写出化学方程式 ____ ;氧化过程的化学方程式为:X+H2SO4+2FeSO4=Fe2(SO4)3+2H2O。X化学式是 ____ ,X作氧化剂的优点 ____ 。
(3)为提高产品纯度,控制的pH范围是 ____ ;试剂Y为 ____ (填选项)。
A.MgO
B.Fe2O3
C.Fe(OH)3
D.Mg(OH)2
(4)为测量所得硼酸纯度,取3.00g制取的硼酸样品溶于甘露醇与蒸馏水混合溶液中配成500mL溶液,取出25.00mL放入锥形瓶并滴加3滴酚酞试液,用0.004g/mLNaOH标准溶液进行中和滴定,滴定终点时消耗22.00mL标准溶液。则滴定终点时的现象是 ____ ,样品中硼酸的纯度是 ____ ?(请写出计算过程,小数点后保留一位有效数字,中和反应的化学方程式为H3BO3+NaOH═NaH2BO3+H2O)。
(5)操作Z包括: ____ 、 ____ 、过滤、洗涤、干燥。
(6)此工艺流程中提高硼酸产率措施有: ____ 、 ____ ……
题目解答
答案
解:(1)为了使反应更快更充分,需要将矿石粉碎以增加反应物的接触面积,所以预处理的内容包括矿石的筛选、粉碎。矿石中的SiO2不和硫酸反应,氧化亚铁、氧化铁、氧化铝和硫酸反应生成可溶性物质,Mg2B2O5⋅H2O应与硫酸反应否则后续不会有含硼物质生成,所以料渣1的化学式SiO2;
(2)Mg2B2O5⋅H2O 与硫酸反应生成硫酸镁和硼酸,化学方程式为:Mg2B2O5⋅H2O+2H2SO4=2MgSO4+2H3BO3。化学反应前后原子的种类和数目不变,反应后有2Fe、3SO4、4H、2O,反应前有2Fe、3SO4、2H,则X含有2H、2O,为H2O2;X作为氧化剂可以提供氧,同时不会引入新杂质。所以X作氧化剂的优点是不会引入新杂质;
(3)从调节pH后有碳酸镁生成,有硼酸存在,则pH要使铁离子、铝离子全部沉淀(亚铁离子在氧化过程中已经全部转化为铁离子,不考虑亚铁离子沉淀),镁离子不沉淀,则控制的pH范围是5.2~9.6;
A、MgO可以和硫酸反应生成硫酸镁和水,可以消耗硫酸,调节溶液pH,故正确;
B、氧化铁和硫酸反应生成硫酸铁和水,可以消耗硫酸,但会引入杂质离子铁离子,浪费原料,故错误;
C、氢氧化铁和硫酸反应生成硫酸铁和水,可以消耗硫酸,但会引入杂质离子铁离子,浪费原料,故错误;
D、氢氧化镁和硫酸反应生成硫酸镁和水,可以消耗硫酸,调节溶液pH,故正确。
故选:AD;
(4)酚酞试液在酸性和中性溶液中为无色,在碱性溶液中为红色,滴入的是氢氧化钠,如氢氧化钠过量溶液为碱性,酚酞试剂会变红。则滴定终点的现象是滴入最后一滴 NaOH标准溶液,溶液恰好变成红色,且半分钟内不褪色;
使用的硼酸样品的质量为3g$\frac{25mL}{500mL}$=0.15g
消耗氢氧化钠的质量为22.00mL×0.004g/mL=0.088g。
设反应的硼酸的质量为x。
H3BO3+NaOH=NaH2BO3+H2O
62 40
x 0.088g
$\frac{62}{40}$=x$\frac{x}{0.088g}$
x=0.1364g
样品中硼酸的纯度为$\frac{0.1364g}{0.15g}×100%≈90.9%$。
答:样品中硼酸的纯度是90.9%;
(5)操作Z得到硼酸和溶液,结合硼酸的溶解度0℃溶解度仅为2.77g,100℃溶解度为38.00g相差较大,可用降温结晶的方法获得,所以操作Z为加热浓缩,冷却结晶,过滤、洗涤、干燥;
(6)从硼酸溶解度可知,温度越低硼酸溶解度越小,则使用冰水洗涤可以减少硼酸溶解损失,提高产率。也可以使用饱和硼酸溶液进行洗涤,饱和硼酸溶液不能溶解硼酸但能溶解其他杂质,可以避免硼酸损失,提高产率。
故答案为:(1)粉碎;SiO2;
(2)Mg2B2O5⋅H2O+2H2SO4=2MgSO4+2H3BO3;H2O2;不会引入新杂质;
(3)5.2~9.6;AD;
(4)滴入最后一滴 NaOH标准溶液,溶液恰好变成红色,且半分钟内不褪色;90.9%;
(5)加热浓缩;冷却结晶;
(6)使用冰水洗涤;使用硼酸饱和溶液洗涤等。
(2)Mg2B2O5⋅H2O 与硫酸反应生成硫酸镁和硼酸,化学方程式为:Mg2B2O5⋅H2O+2H2SO4=2MgSO4+2H3BO3。化学反应前后原子的种类和数目不变,反应后有2Fe、3SO4、4H、2O,反应前有2Fe、3SO4、2H,则X含有2H、2O,为H2O2;X作为氧化剂可以提供氧,同时不会引入新杂质。所以X作氧化剂的优点是不会引入新杂质;
(3)从调节pH后有碳酸镁生成,有硼酸存在,则pH要使铁离子、铝离子全部沉淀(亚铁离子在氧化过程中已经全部转化为铁离子,不考虑亚铁离子沉淀),镁离子不沉淀,则控制的pH范围是5.2~9.6;
A、MgO可以和硫酸反应生成硫酸镁和水,可以消耗硫酸,调节溶液pH,故正确;
B、氧化铁和硫酸反应生成硫酸铁和水,可以消耗硫酸,但会引入杂质离子铁离子,浪费原料,故错误;
C、氢氧化铁和硫酸反应生成硫酸铁和水,可以消耗硫酸,但会引入杂质离子铁离子,浪费原料,故错误;
D、氢氧化镁和硫酸反应生成硫酸镁和水,可以消耗硫酸,调节溶液pH,故正确。
故选:AD;
(4)酚酞试液在酸性和中性溶液中为无色,在碱性溶液中为红色,滴入的是氢氧化钠,如氢氧化钠过量溶液为碱性,酚酞试剂会变红。则滴定终点的现象是滴入最后一滴 NaOH标准溶液,溶液恰好变成红色,且半分钟内不褪色;
使用的硼酸样品的质量为3g$\frac{25mL}{500mL}$=0.15g
消耗氢氧化钠的质量为22.00mL×0.004g/mL=0.088g。
设反应的硼酸的质量为x。
H3BO3+NaOH=NaH2BO3+H2O
62 40
x 0.088g
$\frac{62}{40}$=x$\frac{x}{0.088g}$
x=0.1364g
样品中硼酸的纯度为$\frac{0.1364g}{0.15g}×100%≈90.9%$。
答:样品中硼酸的纯度是90.9%;
(5)操作Z得到硼酸和溶液,结合硼酸的溶解度0℃溶解度仅为2.77g,100℃溶解度为38.00g相差较大,可用降温结晶的方法获得,所以操作Z为加热浓缩,冷却结晶,过滤、洗涤、干燥;
(6)从硼酸溶解度可知,温度越低硼酸溶解度越小,则使用冰水洗涤可以减少硼酸溶解损失,提高产率。也可以使用饱和硼酸溶液进行洗涤,饱和硼酸溶液不能溶解硼酸但能溶解其他杂质,可以避免硼酸损失,提高产率。
故答案为:(1)粉碎;SiO2;
(2)Mg2B2O5⋅H2O+2H2SO4=2MgSO4+2H3BO3;H2O2;不会引入新杂质;
(3)5.2~9.6;AD;
(4)滴入最后一滴 NaOH标准溶液,溶液恰好变成红色,且半分钟内不褪色;90.9%;
(5)加热浓缩;冷却结晶;
(6)使用冰水洗涤;使用硼酸饱和溶液洗涤等。