题目
时,向溶液中滴加溶液,滴定曲线如图所示。下列说法正确的是( )。 A. 该滴定过程应该选择石蕊试液作指示剂 B. W点到X点发生的主要反应的离子方程式为 C. Y点对应的溶液中 D. 反应的平衡常数
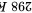 时,向
时,向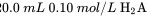 溶液中滴加
溶液中滴加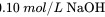 溶液,滴定曲线如图所示。下列说法正确的是( )。
溶液,滴定曲线如图所示。下列说法正确的是( )。
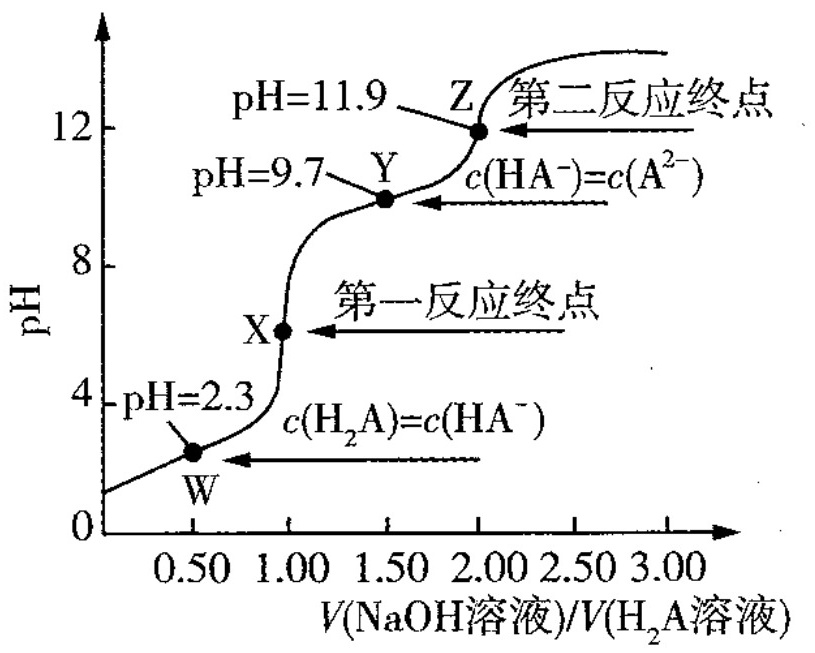
A. 该滴定过程应该选择石蕊试液作指示剂
B. W点到X点发生的主要反应的离子方程式为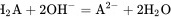
C. Y点对应的溶液中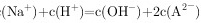
D. 反应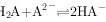 的平衡常数
的平衡常数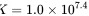
题目解答
答案
D
解析
步骤 1:分析滴定曲线
滴定曲线显示了在滴定过程中pH值的变化。从图中可以看出,滴定曲线有两个明显的突跃点,分别对应于${H}_{2}A$的第一步和第二步电离。第一个突跃点(W点到X点)对应于${H}_{2}A$的第一步电离,第二个突跃点(X点到Y点)对应于${HA}^{-}$的第二步电离。
步骤 2:分析滴定过程中的主要反应
在W点到X点,${H}_{2}A$与$NaOH$反应生成${HA}^{-}$和${H}_{2}O$。在X点到Y点,${HA}^{-}$与$NaOH$反应生成${A}^{2-}$和${H}_{2}O$。因此,W点到X点发生的主要反应的离子方程式为${H}_{2}A+{OH}^{-}={HA}^{-}+{H}_{2}O$,而不是${I}_{2}A+2{OH}^{-}={A}^{2-}+2{H}_{2}O$。
步骤 3:分析Y点对应的溶液中离子浓度关系
在Y点,${HA}^{-}$和${A}^{2-}$的浓度相等。根据电荷守恒,溶液中阳离子的总浓度等于阴离子的总浓度。因此,$c({Na}^{+})+c({H}^{+})=c({OH}^{-})+c({HA}^{-})+2c({A}^{2-})$。由于$c({HA}^{-})=c({A}^{2-})$,可以简化为$c({Na}^{+})+c({H}^{+})=c({OH}^{-})+2c({A}^{2-})$。
步骤 4:计算反应${H}_{2}A+{A}^{2-}=2{HA}^{-}$的平衡常数
根据滴定曲线,可以确定${H}_{2}A$的第一步和第二步电离的pKa值。根据pKa值,可以计算出反应${H}_{2}A+{A}^{2-}=2{HA}^{-}$的平衡常数。根据题目给出的pKa值,可以计算出平衡常数$=1.0\times {10}^{7}$。
滴定曲线显示了在滴定过程中pH值的变化。从图中可以看出,滴定曲线有两个明显的突跃点,分别对应于${H}_{2}A$的第一步和第二步电离。第一个突跃点(W点到X点)对应于${H}_{2}A$的第一步电离,第二个突跃点(X点到Y点)对应于${HA}^{-}$的第二步电离。
步骤 2:分析滴定过程中的主要反应
在W点到X点,${H}_{2}A$与$NaOH$反应生成${HA}^{-}$和${H}_{2}O$。在X点到Y点,${HA}^{-}$与$NaOH$反应生成${A}^{2-}$和${H}_{2}O$。因此,W点到X点发生的主要反应的离子方程式为${H}_{2}A+{OH}^{-}={HA}^{-}+{H}_{2}O$,而不是${I}_{2}A+2{OH}^{-}={A}^{2-}+2{H}_{2}O$。
步骤 3:分析Y点对应的溶液中离子浓度关系
在Y点,${HA}^{-}$和${A}^{2-}$的浓度相等。根据电荷守恒,溶液中阳离子的总浓度等于阴离子的总浓度。因此,$c({Na}^{+})+c({H}^{+})=c({OH}^{-})+c({HA}^{-})+2c({A}^{2-})$。由于$c({HA}^{-})=c({A}^{2-})$,可以简化为$c({Na}^{+})+c({H}^{+})=c({OH}^{-})+2c({A}^{2-})$。
步骤 4:计算反应${H}_{2}A+{A}^{2-}=2{HA}^{-}$的平衡常数
根据滴定曲线,可以确定${H}_{2}A$的第一步和第二步电离的pKa值。根据pKa值,可以计算出反应${H}_{2}A+{A}^{2-}=2{HA}^{-}$的平衡常数。根据题目给出的pKa值,可以计算出平衡常数$=1.0\times {10}^{7}$。