题目
6.在293K时,氨的水溶液A中NH3与H 2O的量之比为1:8.5,溶液A上-|||-方NH3的分压为10.64 kPa;氨的水溶液B中NH3与H2 O的量之比为1:21,溶-|||-液B上方NH3的分压为3.597 kPa。试求在相同温度下:-|||-(1)从大量的溶液A中转移1 mol NH3(g)到大量的溶液B中的 Delta G;-|||-(2)将处于标准压力下的1 mol NH3(g)溶于大量的溶液B中的 Delta G

题目解答
答案
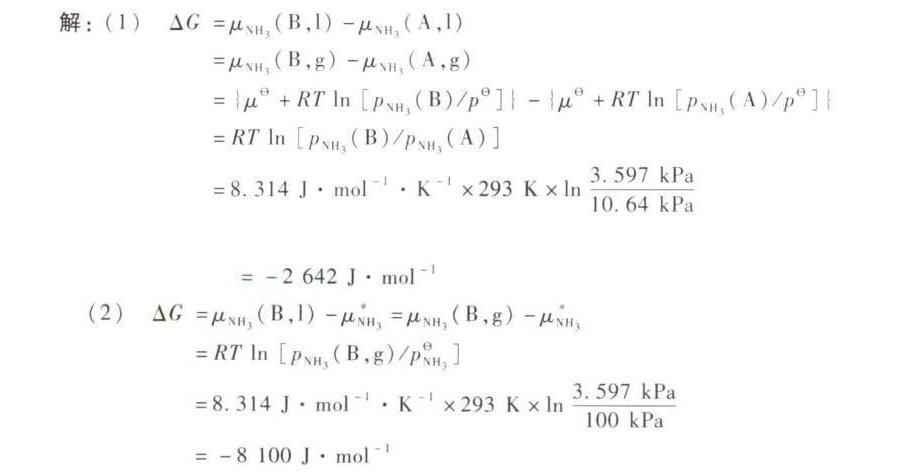
解析
考查要点:本题主要考查化学势的概念及吉布斯自由能变化($\Delta G$)的计算,涉及溶液中溶质的化学势与分压的关系。
解题核心思路:
- 化学势差决定物质转移方向:$\Delta G = \mu_{\text{终}} - \mu_{\text{初}}$,其中$\mu$为化学势。
- 理想溶液化学势公式:$\mu = \mu^\theta + RT \ln P$,其中$P$为溶液上方溶质的分压。
- 分压比值计算:通过溶液上方的分压直接计算化学势差,无需考虑溶液内部浓度。
破题关键点:
- 问题(1):比较溶液A和B中NH₃的分压,直接代入公式$\Delta G = RT \ln \frac{P_B}{P_A}$。
- 问题(2):将标准压力下的气体与溶液B的分压对比,公式为$\Delta G = RT \ln \frac{P_B}{P^\theta}$。
第(1)题
关键步骤:
- 化学势差公式:
$\Delta G = \mu_{\text{NH}_3}(B) - \mu_{\text{NH}_3}(A)$ - 代入理想溶液公式:
$\mu = \mu^\theta + RT \ln P$,因此:
$\Delta G = RT \ln \frac{P_{\text{NH}_3}(B)}{P_{\text{NH}_3}(A)}$ - 代入数据:
$P_A = 10.64 \, \text{kPa}$,$P_B = 3.597 \, \text{kPa}$,$R = 8.314 \, \text{J/mol·K}$,$T = 293 \, \text{K}$,计算得:
$\Delta G = 8.314 \times 293 \times \ln \frac{3.597}{10.64} = -2642 \, \text{J/mol}$
第(2)题
关键步骤:
- 化学势差公式:
$\Delta G = \mu_{\text{NH}_3}(B) - \mu_{\text{NH}_3}^\theta$ - 代入理想溶液公式:
$\mu_{\text{NH}_3}^\theta = \mu^\theta + RT \ln P^\theta$(标准压力$P^\theta = 100 \, \text{kPa}$),因此:
$\Delta G = RT \ln \frac{P_{\text{NH}_3}(B)}{P^\theta}$ - 代入数据:
$P_B = 3.597 \, \text{kPa}$,计算得:
$\Delta G = 8.314 \times 293 \times \ln \frac{3.597}{100} = -8100 \, \text{J/mol}$