在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采取下面的工艺流程生产单质碘。④稀H2 SO4浸洗-|||-Ag square -|||-⑤HNO5溶液-|||-①加AgNO3 Ag-|||-ī ②过滤,水洗 甲 眉,搅拌 ⑥通-|||-溶液 ③适量Fe-|||-水 弃去母液 乙 适量Cl2 溶液-|||-I2-|||-I2 ⑦提纯试回答下列问题:(1)乙、丁中溶质的化学式:乙________________;丁_____________________。(2)第④步操作中用稀H2SO4浸洗的目的是_____________________(填写字母编号)A.除去未反应的NO3-B.除去未反应的I-C.除去未反应的FeD.除去碱性物质(3)第⑦步操作可供提纯I2的两种方法是___________和______________(不要求写具体步骤)。(4)实验室检验I2的方法是_______________________________________。(5)甲物质见光易变黑,其原因是(用化学方程式表示)______________________。探究解题新思路▲基础思维探究题型一、有关镁及其化合物的简单计算典例1:把等质量的金属镁分别放在:①纯氧气(O2)中;②二氧化碳气体中;③空气中。完全燃烧后,得到的固体物质的质量分别对应的是w1g,w2g和w3g。以上三者的关系正确的是A.w1>w2>w3B.w3>w1>w2C.w3>w2>w1D.w2>w1>w3方法导引:既然Mg的质量相等,不妨设为1 mol,可以降低计算难度。空气中主要含有N2和O2,比较Mg在O2与空气中燃烧产物质量的不同,也就是比较Mg在O2与N2中燃烧产物质量的不同,因此又不妨将空气极限为N2而比之。忽视Mg与CO2反应产生的C也是固体,是导致本题误解的主要因素。题型二、卤素单质的氧化性典例2:在100 mL含等物质的量HBr和H2SO3的溶液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于A.0.0075 mol·L-1B.0.18 mol·L-1C.0.075 mol·L-1D.0.08 mol·L-1友情提醒:一种氧化剂同时与几种还原剂相遇时,还原性强的首先被氧化;这是氧化还原反应的规律。此外,“还原剂的还原性强于还原产物”,这也是重要反应规律。掌握好这些基本规律,是解决氧化还原反应问题的前提。▲综合思维探究题型一、学科内综合题典例3:化学上将SCN-、OCN-、CN-等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成红色。将此红色溶液分成两份:一份中________________________________(1)向另一份中________________________________(2)________________________________(3)试用离子方程式解释以上三部分颜色变化的原因(方程式可以不配平)。考向指南:《考试大纲》明确规定,考生必须要具备一定的接受信息,处理信息的能力,因此像这种信息题是高考的必考题型。“类卤素”是经常考到的知识点,我们应该可以依据卤素的性质推测“类卤素”的性质,并进行应用。“类卤素”如:(CN)2、(SCN)2、(OCN)2、IBr等性质与卤素相似,表现在氧化性、与碱溶液反应生成卤化物和次卤酸盐、与Ag+结合的生成物的难溶性等。但是,由于类卤素的组成不是一种元素,其各元素的化合价有差别,以致在参加化学反应中价态的变化与卤素单质不完全相同。如IBr+H2O=HBr+HIO的反应不属于氧化还原反应等。题型二、实际应用题典例4:为实现中国消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3-可和I-发生反应:IO3-+5I-+6H+=3I2+3H2O根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是(碘单质可使淀粉变蓝色,用于碘的检验)A.①③B.③⑥C.②④⑥D.①②④⑤⑦总结提升:是物质检验实验方案设计类型题。解答的关键是依据反应原理IO3-+5I-+6H+=3I2+3H2O,分析检验实验所用的药品,并在给定的范围内选出,然后逐步讨论实验操作步骤。本题的易错点是多选自来水。题型三、学科间渗透题典例5:碘缺乏症遍及全球,多发生于山区。南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有1000万人。为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:(1)碘是合成下列哪种激素的主要原料之一A.胰岛素B.甲状腺激素C.生长激素D.雄性激素(2)长期生活在缺碘山区,又得不到碘盐的供应,易患A.甲状腺亢进B.佝偻病C.地方性甲状腺肿D.糖尿病(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为。氧化产物与还原产物的物质的量之比为。能观察到的明显现象是。(4)已知KIO3可用电解方法制得。总反应化学方程式为:KI+3H2OKIO3+3H2↑。在某温度下.若以12 A的电流强度电解KI溶液10 min.理论上可得标况下氢气___________L。友情提醒:卤素及其化合物在化学学科内卤素有明显的交汇、综合,这一知识正符合“3+X”的学科内综合。由于微量元素碘对生物体的生命活动起着重要作用(碘是合成甲状腺激素不可缺少的原料,体内缺碘,易患“大脖子病”)。因此,以碘为素材的学科间综合也应引起注意。▲创新思维探究题型一、开放探究题典例6:X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如下图关系:试根据该图推断X、Y、Z的化学式(答案不止一组,请尽可能多地寻找合理解答)。考向指南:开放性试题能考查同学们的发散思维能力、对知识掌握的系统性情况。开放性试题是2005年高考化学试题的一个重要特点,反响很好。估计今后会继承和发扬。本题开放程度特别高,除了上述几组答案外,随着我们学习的深入,还会有更多符合题意的答案,希望同学们注意。题型二、社会热点题典例7:近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是A.B.C.D.课标点击:在科技高速发展的今天,资源问题、环境问题日益严重。因此,“绿色化学”的思想新课标中显得特别重要。“绿色化学”的思想也自然成了我们设计制备实验的首要原则。题型三、课标思维题典例8:海水是一个巨大的资源宝库,下图从海水中提取镁的流程图。(1)①~⑤中,属于氧化还原反应的是(填序号)。(2)请写出反应②的离子方程式:。(3)在用上述方法提镁的过程中,采取了那些措施来提高经济效益?课标点击:新课标下的新教材特点之一就是“大视野、高观点”。我们根据海水提镁流程图可以从宏观上把握海水提镁的过程、原理等一系列问题。在此基础上,再具体考查我们必须掌握的氧化还原反应以及离子反应等知识。初步认识工业生产中的一些问题。▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲高考思维探究[考题1](2005上海-4)下列金属冶炼的反应原理,错误的是A2NaCl熔融④稀H2 SO4浸洗-|||-Ag square -|||-⑤HNO5溶液-|||-①加AgNO3 Ag-|||-ī ②过滤,水洗 甲 眉,搅拌 ⑥通-|||-溶液 ③适量Fe-|||-水 弃去母液 乙 适量Cl2 溶液-|||-I2-|||-I2 ⑦提纯2Na+Cl2BMgO+H2Mg+2H2OCFe3O4+CO④稀H2 SO4浸洗-|||-Ag square -|||-⑤HNO5溶液-|||-①加AgNO3 Ag-|||-ī ②过滤,水洗 甲 眉,搅拌 ⑥通-|||-溶液 ③适量Fe-|||-水 弃去母液 乙 适量Cl2 溶液-|||-I2-|||-I2 ⑦提纯3Fe+4COD2HgO2Hg+O2启发引申:冶炼金属有多种方法,不活泼金属可以用加热法;铁等较活泼的金属就需要CO等还原剂还原才能冶炼出来;而Mg、Na等活泼金属只能用电解法。[考题2](2005广东-21)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有填代号、限填3项。A试管B瓷坩埚C坩埚钳D铁三角架E泥三角F酒精灯D烧杯H量筒(2)第2步:I溶液的获取。操作是。(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用填代号。A.浓硫酸B.新制氯水C.KMnO4溶液D.H2O2理由是。(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。友情提醒:本题是运用化学视角观察生活、生产和社会中有关化学问题的典型题目。其社会生活背景是自然资源的利用,具体情景是要从海洋植物海藻中提取碘。因此出发点着重考查了化学实验的基本操作技能。集选择、填空、问答等题型于一体.分析时要注意引导学生理解有关实验的基本原理,掌握分析问题的基本方法思路,并强调解答问题的规范性和准确性。优化考题新演练
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采取下面的工艺流程生产单质碘。
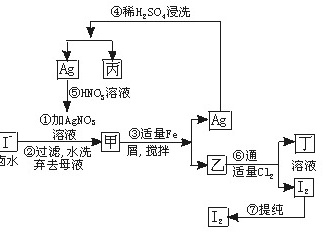
试回答下列问题:
(1)乙、丁中溶质的化学式:乙________________;丁_____________________。
(2)第④步操作中用稀H2SO4浸洗的目的是_____________________(填写字母编号)
A.除去未反应的NO3-B.除去未反应的I-
C.除去未反应的FeD.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是___________和______________(不要求写具体步骤)。
(4)实验室检验I2的方法是_______________________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)______________________。
探究解题新思路
▲基础思维探究
题型一、有关镁及其化合物的简单计算
典例1:把等质量的金属镁分别放在:①纯氧气(O2)中;②二氧化碳气体中;③空气中。完全燃烧后,得到的固体物质的质量分别对应的是w1g,w2g和w3g。以上三者的关系正确的是
A.w1>w2>w3B.w3>w1>w2
C.w3>w2>w1D.w2>w1>w3
方法导引:既然Mg的质量相等,不妨设为1 mol,可以降低计算难度。空气中主要含有N2和O2,比较Mg在O2与空气中燃烧产物质量的不同,也就是比较Mg在O2与N2中燃烧产物质量的不同,因此又不妨将空气极限为N2而比之。忽视Mg与CO2反应产生的C也是固体,是导致本题误解的主要因素。
题型二、卤素单质的氧化性
典例2:在100 mL含等物质的量HBr和H2SO3的溶液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.0.0075 mol·L-1B.0.18 mol·L-1
C.0.075 mol·L-1D.0.08 mol·L-1
友情提醒:一种氧化剂同时与几种还原剂相遇时,还原性强的首先被氧化;这是氧化还原反应的规律。此外,“还原剂的还原性强于还原产物”,这也是重要反应规律。掌握好这些基本规律,是解决氧化还原反应问题的前提。
▲综合思维探究
题型一、学科内综合题
典例3:化学上将SCN-、OCN-、CN-等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成红色。将此红色溶液分成两份:一份中________________________________(1)向另一份中________________________________(2)________________________________(3)试用离子方程式解释以上三部分颜色变化的原因(方程式可以不配平)。
考向指南:《考试大纲》明确规定,考生必须要具备一定的接受信息,处理信息的能力,因此像这种信息题是高考的必考题型。“类卤素”是经常考到的知识点,我们应该可以依据卤素的性质推测“类卤素”的性质,并进行应用。“类卤素”如:(CN)2、(SCN)2、(OCN)2、IBr等性质与卤素相似,表现在氧化性、与碱溶液反应生成卤化物和次卤酸盐、与Ag+结合的生成物的难溶性等。但是,由于类卤素的组成不是一种元素,其各元素的化合价有差别,以致在参加化学反应中价态的变化与卤素单质不完全相同。如IBr+H2O=HBr+HIO的反应不属于氧化还原反应等。
题型二、实际应用题
典例4:为实现中国消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3-可和I-发生反应:IO3-+5I-+6H+=3I2+3H2O根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是(碘单质可使淀粉变蓝色,用于碘的检验)
A.①③B.③⑥C.②④⑥D.①②④⑤⑦
总结提升:是物质检验实验方案设计类型题。解答的关键是依据反应原理IO3-+5I-+6H+=3I2+3H2O,分析检验实验所用的药品,并在给定的范围内选出,然后逐步讨论实验操作步骤。本题的易错点是多选自来水。
题型三、学科间渗透题
典例5:碘缺乏症遍及全球,多发生于山区。南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有1000万人。为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一
A.胰岛素B.甲状腺激素C.生长激素D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患
A.甲状腺亢进B.佝偻病C.地方性甲状腺肿D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为。氧化产物与还原产物的物质的量之比为。能观察到的明显现象是。
(4)已知KIO3可用电解方法制得。总反应化学方程式为:KI+3H2OKIO3+3H2↑。在某温度下.若以12 A的电流强度电解KI溶液10 min.理论上可得标况下氢气___________L。
友情提醒:卤素及其化合物在化学学科内卤素有明显的交汇、综合,这一知识正符合“3+X”的学科内综合。由于微量元素碘对生物体的生命活动起着重要作用(碘是合成甲状腺激素不可缺少的原料,体内缺碘,易患“大脖子病”)。因此,以碘为素材的学科间综合也应引起注意。
▲创新思维探究
题型一、开放探究题
典例6:X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如下图关系:
试根据该图推断X、Y、Z的化学式(答案不止一组,请尽可能多地寻找合理解答)。
考向指南:开放性试题能考查同学们的发散思维能力、对知识掌握的系统性情况。开放性试题是2005年高考化学试题的一个重要特点,反响很好。估计今后会继承和发扬。本题开放程度特别高,除了上述几组答案外,随着我们学习的深入,还会有更多符合题意的答案,希望同学们注意。
题型二、社会热点题
典例7:近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是
A.
B.
C.
D.
课标点击:在科技高速发展的今天,资源问题、环境问题日益严重。因此,“绿色化学”的思想新课标中显得特别重要。“绿色化学”的思想也自然成了我们设计制备实验的首要原则。
题型三、课标思维题
典例8:海水是一个巨大的资源宝库,下图从海水中提取镁的流程图。
(1)①~⑤中,属于氧化还原反应的是(填序号)。
(2)请写出反应②的离子方程式:。
(3)在用上述方法提镁的过程中,采取了那些措施来提高经济效益?
课标点击:新课标下的新教材特点之一就是“大视野、高观点”。我们根据海水提镁流程图可以从宏观上把握海水提镁的过程、原理等一系列问题。在此基础上,再具体考查我们必须掌握的氧化还原反应以及离子反应等知识。初步认识工业生产中的一些问题。
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲
▲高考思维探究
[考题1](2005上海-4)下列金属冶炼的反应原理,错误的是
A2NaCl熔融 2Na+Cl2BMgO+H2Mg+2H2O
2Na+Cl2BMgO+H2Mg+2H2O
CFe3O4+CO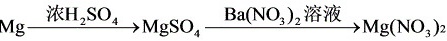 3Fe+4COD2HgO2Hg+O2
3Fe+4COD2HgO2Hg+O2
启发引申:冶炼金属有多种方法,不活泼金属可以用加热法;铁等较活泼的金属就需要CO等还原剂还原才能冶炼出来;而Mg、Na等活泼金属只能用电解法。
[考题2](2005广东-21)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有填代号、限填3项。
A试管B瓷坩埚C坩埚钳D铁三角架E泥三角F酒精灯D烧杯H量筒
(2)第2步:I溶液的获取。操作是。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用填代号。
A.浓硫酸B.新制氯水C.KMnO4溶液D.H2O2
理由是。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
友情提醒:本题是运用化学视角观察生活、生产和社会中有关化学问题的典型题目。其社会生活背景是自然资源的利用,具体情景是要从海洋植物海藻中提取碘。因此出发点着重考查了化学实验的基本操作技能。集选择、填空、问答等题型于一体.分析时要注意引导学生理解有关实验的基本原理,掌握分析问题的基本方法思路,并强调解答问题的规范性和准确性。
优化考题新演练
题目解答
答案
加入 KMnO 4 溶液,红色褪去; 通入 SO 2 时,红色也消失; 再滴加少量 KMnO 4 溶液,其紫色也褪去。