题目
在H H H H-|||-CH3 CH3-|||-N c c c-|||-OH3 H H H OH3 共轭体系中将π电子运动简化为一维势箱模型,势箱长度约为1.30nm,计算π电子跃迁时所吸收光的波长,并与实验值510nm比较。
在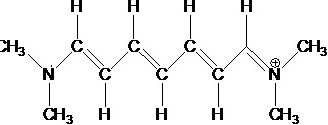 共轭体系中将π电子运动简化为一维势箱模型,势箱长度约为1.30nm,计算π电子跃迁时所吸收光的波长,并与实验值510nm比较。
共轭体系中将π电子运动简化为一维势箱模型,势箱长度约为1.30nm,计算π电子跃迁时所吸收光的波长,并与实验值510nm比较。
题目解答
答案
解: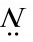 上的一对电子计算在内,共有10个π电子,所以填充的轨道数n为5,
上的一对电子计算在内,共有10个π电子,所以填充的轨道数n为5, 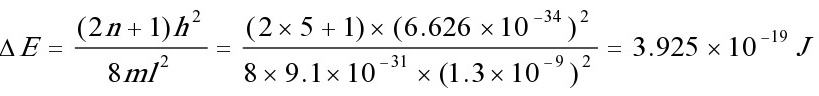
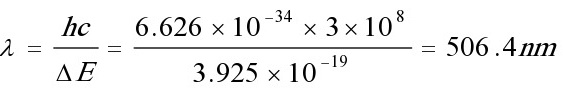
估算的吸收光的波长506.4nm与实验值510nm相接近。
解析
步骤 1:确定π电子数目
在给定的共轭体系中,每个碳原子贡献一个π电子,氮原子贡献一个π电子。因此,共有10个π电子。
步骤 2:计算π电子跃迁能量
根据一维势箱模型,π电子跃迁的能量差可以通过以下公式计算:
\[ \Delta E = \frac{h^2}{8mL^2} \left( n^2 - (n-1)^2 \right) \]
其中,\( h \) 是普朗克常数,\( m \) 是电子质量,\( L \) 是势箱长度,\( n \) 是填充的轨道数。对于10个π电子,填充的轨道数为5,因此 \( n = 5 \)。
步骤 3:计算吸收光的波长
根据能量和波长的关系,可以计算吸收光的波长:
\[ \lambda = \frac{hc}{\Delta E} \]
其中,\( c \) 是光速。
在给定的共轭体系中,每个碳原子贡献一个π电子,氮原子贡献一个π电子。因此,共有10个π电子。
步骤 2:计算π电子跃迁能量
根据一维势箱模型,π电子跃迁的能量差可以通过以下公式计算:
\[ \Delta E = \frac{h^2}{8mL^2} \left( n^2 - (n-1)^2 \right) \]
其中,\( h \) 是普朗克常数,\( m \) 是电子质量,\( L \) 是势箱长度,\( n \) 是填充的轨道数。对于10个π电子,填充的轨道数为5,因此 \( n = 5 \)。
步骤 3:计算吸收光的波长
根据能量和波长的关系,可以计算吸收光的波长:
\[ \lambda = \frac{hc}{\Delta E} \]
其中,\( c \) 是光速。