第六章化学平衡练习题解答练习6.1 反应的是,它可表示为G-图中的线。化学亲和势是。练习6.2T、p及组成恒定时反应1.,.),的摩尔反应吉布斯函数变1.,.),与化学势的关系是。练习6.3已知气相反应1.,.),在温度T时的标准摩尔反应吉布斯函数变1.,.),(T),用(T)判断反应自动进行的方向和限度的条件是。练习6.4 如用化学亲和势判断反应的方向和程度的判式是。练习6.5 混合吉布斯自由能的定义是,化学反应通常不能进行到底的本质原因是。练习6.6 假设让反应能够进行到底,则使其反应在中进行,使反应物和产物。讨论6-1 化学平衡的热力学条件是什么?它遵循什么原则?化学反应为何不能进行到底?怎样才能进行到底?练习6.7与与分压力的关系不同的地方在于。练习6.8在298 K时反应N2O4(g)=2NO2(g)的1.,.),= 0.1132,当1.,.),时反应将向移动。当p(NO2)=1 kPa时,反应将向移动。练习6.9若用下列两个化学计量方程来表示合成氨的反应, (1),(2)1.,.),1.,.),,1.,.),。________;________。练习6.10标准平衡常数与经验平衡常数的区别是。练习6.11298.15 K时,平衡C6H6(l)1.,.),C6H6(g)的平衡常数,298.15 K时苯的蒸汽压。(已知苯的正常沸点为80.15℃,它在10℃时的蒸汽压为5.96 kPa。)讨论6-2 Vant Hoff等温方程有两种形式,哪种形式更严格?二者之间的差异如何?练习6.12 在温度T,压力p时,理想气体反应的平衡常数比值为。练习6.13 对于理想气体间反应,以各种形式表示的平衡常数中,其值与温度和压力皆有关系的是。练习6.14已知化学反应为,试证明该反应的。练习6.15合成氨反应为3H2(g)+N2(g)2NH3(g),所用反应物氢气和氮气的摩尔比为3:1,在673 K、1000 kPa压力下达成平衡,平衡产物中氨的摩尔分数为0.0385。试求:该反应在该条件下的标准平衡常数。练习6.161.,.),与1.,.),、、的区别是。讨论6-3 标准平衡常数是如何定义的?它与平衡时的压力和浓度关系是不是标准平衡常数的定义式?它们的等式关系是否绝对成立?如果不成立,其差异何在?练习6.171.,.),与平衡的压力的关系式中只出现气相的物质压力原因是。练习6.18分解压是,解离压是,分解压和解离压的区别和联系是。练习6.19设某分解反应为1.,.),,若某平衡常数和解离压力分别为1.,.),,p,写出平衡常数与解离压力的关系式。练习6.20373 K时,反应的。(1)在的抽空容器中,放入0.1 mol,并通入0.2 mol,问最少需通入物质的量为多少的,才能使全部转化成?(2)在373 K,总压为101 325 Pa 时,要在及的混合气体中干燥潮湿的,问混合气体中的分压应为多少才不致使分解?讨论6-4对于纯固相的反应有没有平衡问题?它们与纯物质之间有没有平衡常数的浓度表达式?练习6.21试估计能否像炼铁那样,直接用碳来还原TiO2(s),TiO2(s)+C(s) =Ti(s)+CO2( g)已知:,练习6.22化学反应等温式1.,.),,当选取不同标准态时,反应的1.,.),将和。练习6.23已知298.15 K,水蒸气的标准摩尔生成吉布斯函数1.,.),(H2O,g)=-228.572 kJmol1。在同样的温度下,反应2H2O(g)1.,.),2H2(g)+O2(g)的标准平衡常数1.,.),=。练习6.24NH3(g)制备HNO3的一种工业方法,是将NH3(g)与空气的混合物通过高温下的金属Pt催化剂,主要反应为4NH3(g)+5O2(g)4NO(g)+6H2O(g)。试计算1073K时的标准平衡常数。设反应的不随温度而改变,所需要热力学数据从附录查询。练习6.25已知下列氧化物的标准生成自由能与温度的关系为:,(1)试用计算说明在0.133Pa的真空条件下,用碳粉还原固态MnO生成纯Mn及CO(g)的最低还原温度是多少?(2)在(1)的条件下,用计算说明还原反应能否按下列方程式进行?MnO(s)+C(s)1.,.),2 Mn(s)+ CO2(g).讨论6-5 用1.,.),判断反应方向的前提条件是什么?1.,.),的计算有几种方法?Ellingham 图有何用途?练习6.26对于实际气体温度对1.,.),的影响是,对的随温度的变化趋势是。练习6.27已知FeO(s)+C(s)=CO(g)+Fe(s),反应的1.,.),为正,(设1.,.),随温度而变化),欲使反应正向进行,则有利。练习6.28某反应的与T的关系为/(Jmol1)=83.145T/K-0.83145,则此反应的=。练习6.29实际气体反应CO(g)+H2O(g)=CO2(g)+H2(g)在873 K、100 kPa下达化学平衡,当压力增至5000 kPa时,各气体的逸度系数为:1.,.),,,,,=,变,则平衡点将移动。练习6.30对于理想气体反应CH4(g) + 2O2(g)CO2(g) + 2H2O(g),在恒温下,增加反应系统的总压力,而使系统的体积变小,这时。练习6.31在刚性密闭容器中,有下列理想气体反应达平衡A(g)+B(g)=C(g),若在恒温下加入一定量惰性气体,则平衡将。练习6.32在T=380 K,总压p=2.00 kPa下,反应C6H5C2H5(g)C6H5C2H3(g) +H2(g)的平衡系统中,加入一定量的惰性组分H2O(g),则反应的标准平衡常数;C6H5C2H5(g)的平衡转化率;C6H5C2H3(g)的摩尔分数。讨论6-6 温度、压力、浓度和惰性气体对化学平衡移动的影响体现在哪几个方面?练习6.33甲烷,水蒸气为15的混合气体,在600℃,101.325 MPa下通过催化剂,以生产合成氨用的氢气。设同时发生如下反应:CH4(g)+H2O(g) → CO(g)+3H2(g)1.,.),,CO(g)+H2O(g) → CO2(g)+H2(g)1.,.),,求平衡组成。练习6.34已知反应 (1)1.,.),1.,.),(2)1.,.),1.,.),试回答:(a)在298 K,当,1.,.),和平衡共存时的是多少?(b)当,欲使三者平衡共存,需T为多少?若T超过此值,物相将发生何种变化?讨论6-7 在同时平衡的反应系统计算中,主要需要考虑的是什么?练习6.35反应Fe2O3(s)+2CO(g)2Fe(s)+3CO2(g),在不同温度时的如下:在1393.15 K时,反应2 CO2(g)2CO(g)+O2(g)的为1.4×10-12,则在1393.15 K时,在含有Fe2O3的容器中,O2的分压应该多大才能阻止Fe2O3变为Fe?练习6.36在723K时,将0.10molH2(g)和0.20molCO2(g)通入抽空的瓶中,发生如下的反应:(1) H2(g)+ CO2(g) =CO(g)+ H2O(g),平衡后瓶中的总压为50.66 kPa,经分析知共中水蒸气的摩尔分数为0.10。今在容器中加入过量的氧化钴CoO(s)和金属钴,在容器中又增加了如下两个反应:(2) CoO(s)+ H2(g) = Co(s)+ H2O(g);(3) CoO(s)+ CO(g) =Co(s)+ CO2(g)。经分析知容器中的水蒸气的摩尔分数为0.30.试分别计算这三个反应用摩尔分数表示的平衡常数。讨论6-8 耦合反应和同时平衡反应有无区别?耦合反应的真正用途是什么?练习6.37在T=600 K,总压p=3×105Pa下,反应A(g)+B(g)1.,.),2D(g)达平衡时,各气体物质的量之比为nA/nB=nB/nD=1,则此反应的1.,.),=();=();=()。练习6.3825℃时,水的饱和蒸汽压为3.168kPa,此时液态水的标准摩尔生成Gibbs自由能1.,.),,则水蒸气的标准摩尔生成Gibbs自由能为________________。练习6.39用空气和甲醇蒸气通过银催化剂制备甲醛,在反应过程中银逐渐失去光泽,并且有丝碎裂。试根据下列数据,说明在823K和气体压力为100kPa的反应条件下,银催化剂是否有可能被氧化为氧化银。已知Ag2O(s)的:1.,.),,1.,.),。O2(g),Ag2O(s),Ag(s)在298~823K的温度区间内的平均定压比热容分别为:29.36,65.86,25.35 Jmol1K1。练习6.40反应2Ca(l)+ThO2(s)2CaO(s)+Th(s),在1373K时1.,.),kJmol1,在1473K时kJmol1,试估计Ca(l)能还原ThO2(s)的最高温度T为。练习6.41两种硫化汞晶体转换反应:,转换反应的标准Gibbs自由能的变化值与温度的关系为:。(1)问在373K时,哪一种硫化汞晶体较为稳定?(2)求该反应的转换温度.练习6.42已知有关氧化物的标准生成自由能为:,1.,.),。试计算:(1)在0.13333 Pa的真空条件下,用炭粉还原固态MnO生成纯Mn及CO的最低还原点温度是多少?(2)在(1)的条件下还原反应能否按下列方程式进行?讨论6-9 估算和反应的转折温度时产生的误差来源哪些方面?§4.10复习总结自测与提高
第六章化学平衡练习题解答
练习6.1 反应的是,它可表示为G-图中的线。化学亲和势是。
练习6.2T、p及组成恒定时反应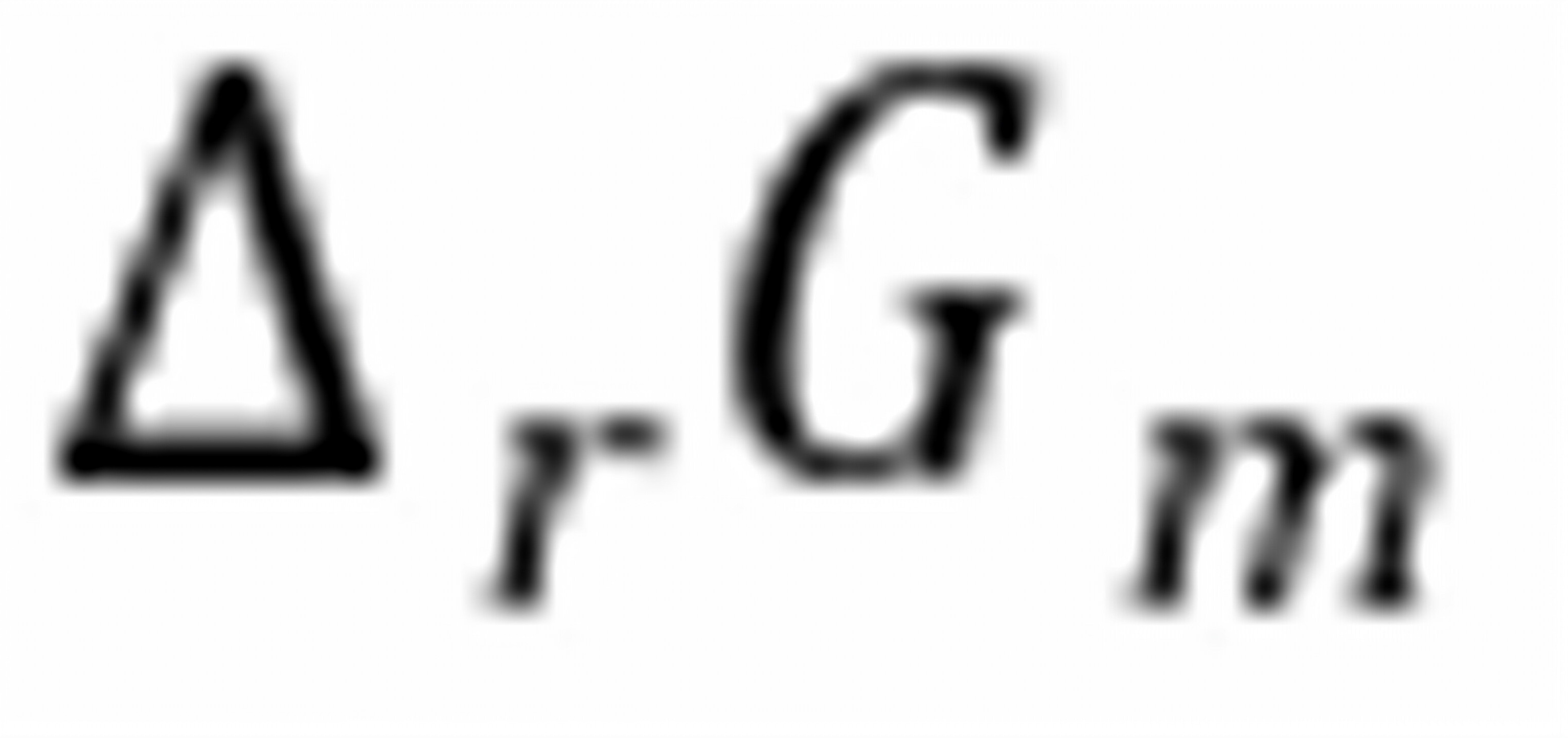 的摩尔反应吉布斯函数变
的摩尔反应吉布斯函数变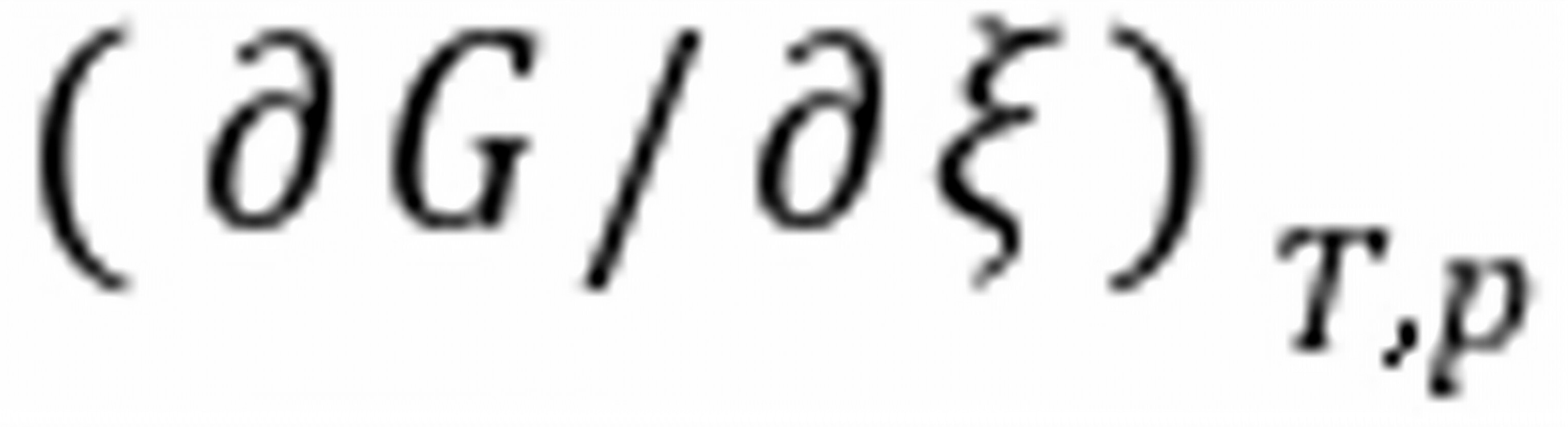 与化学势的关系是。
与化学势的关系是。
练习6.3已知气相反应 在温度T时的标准摩尔反应吉布斯函数变
在温度T时的标准摩尔反应吉布斯函数变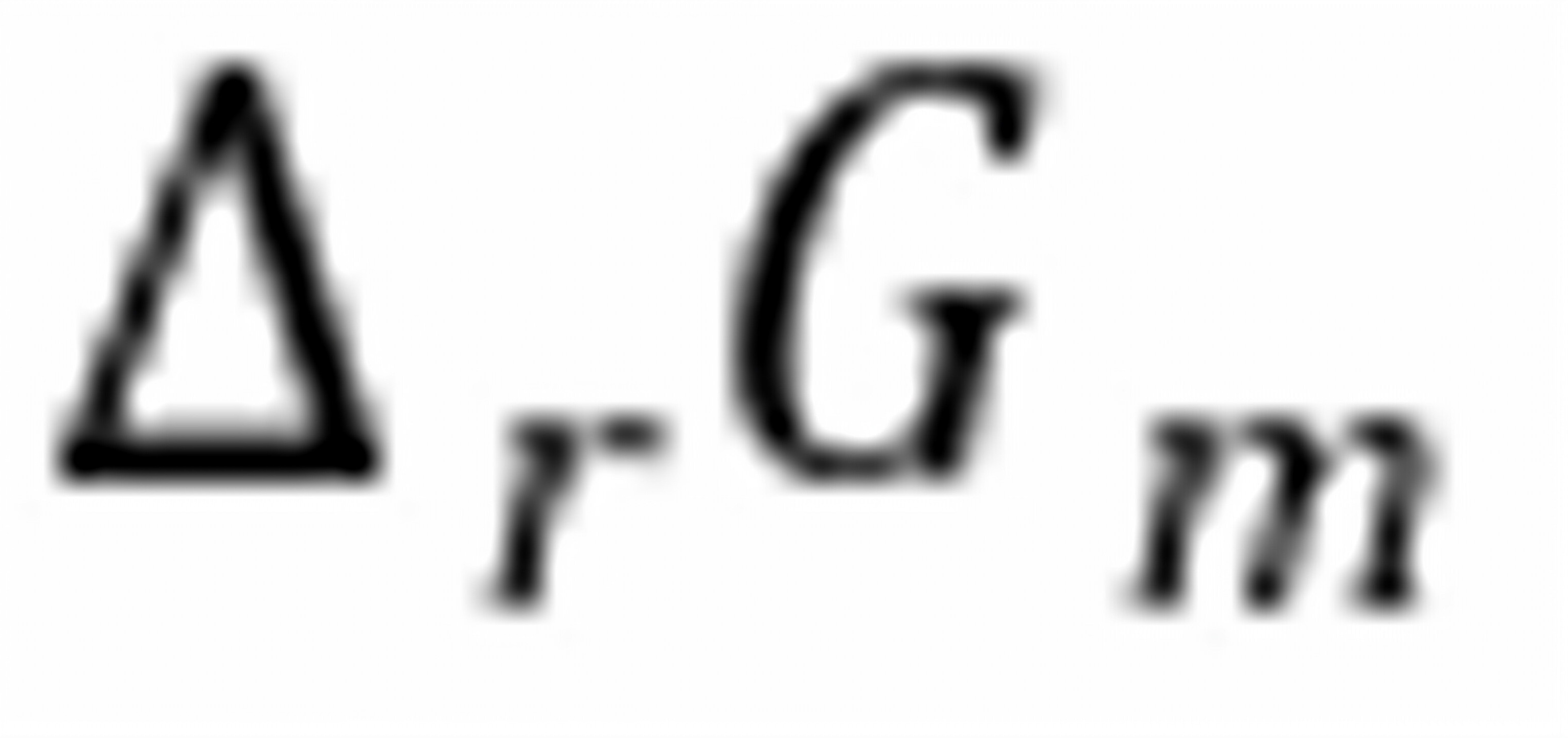 (T),用(T)判断反应自动进行的方向和限度的条件是。
(T),用(T)判断反应自动进行的方向和限度的条件是。
练习6.4 如用化学亲和势判断反应的方向和程度的判式是。
练习6.5 混合吉布斯自由能的定义是,化学反应通常不能进行到底的本质原因是。
练习6.6 假设让反应能够进行到底,则使其反应在中进行,使反应物和产物。
讨论6-1 化学平衡的热力学条件是什么?它遵循什么原则?化学反应为何不能进行到底?怎样才能进行到底?
练习6.7与与分压力的关系不同的地方在于。
练习6.8在298 K时反应N2O4(g)=2NO2(g)的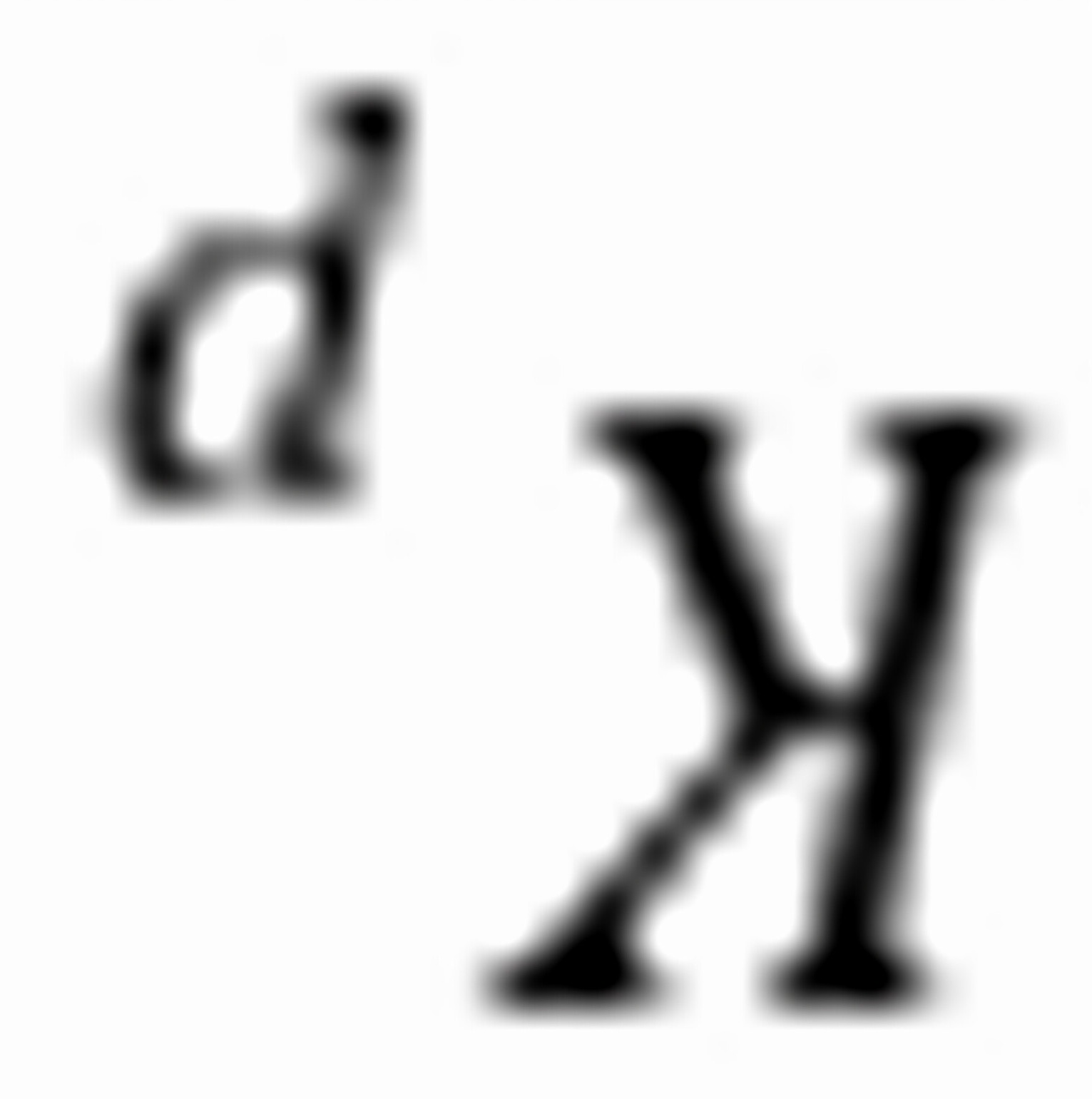 = 0.1132,当
= 0.1132,当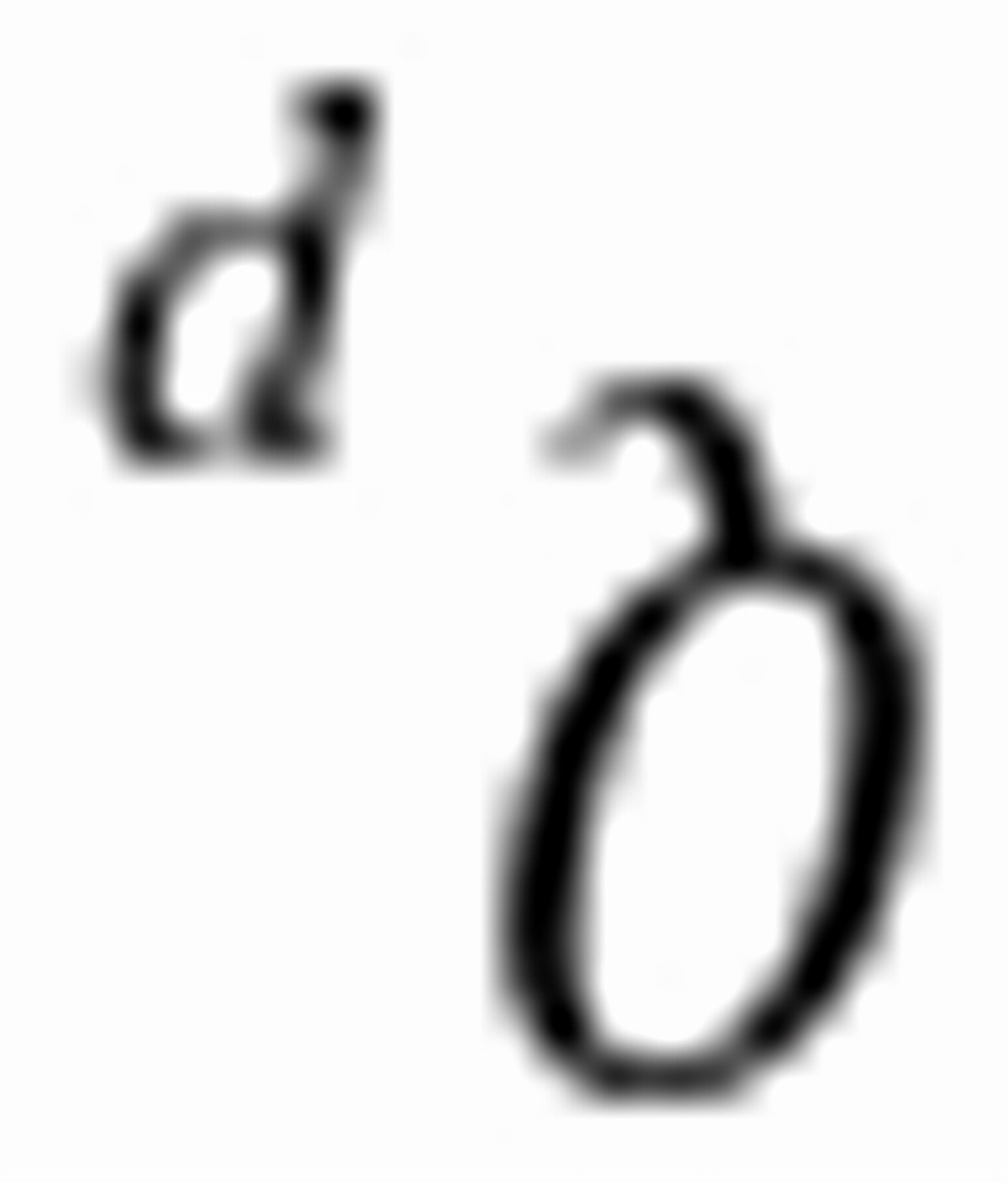 时反应将向移动。当p(NO2)=1 kPa时,反应将向移动。
时反应将向移动。当p(NO2)=1 kPa时,反应将向移动。
练习6.9若用下列两个化学计量方程来表示合成氨的反应, (1),
(2)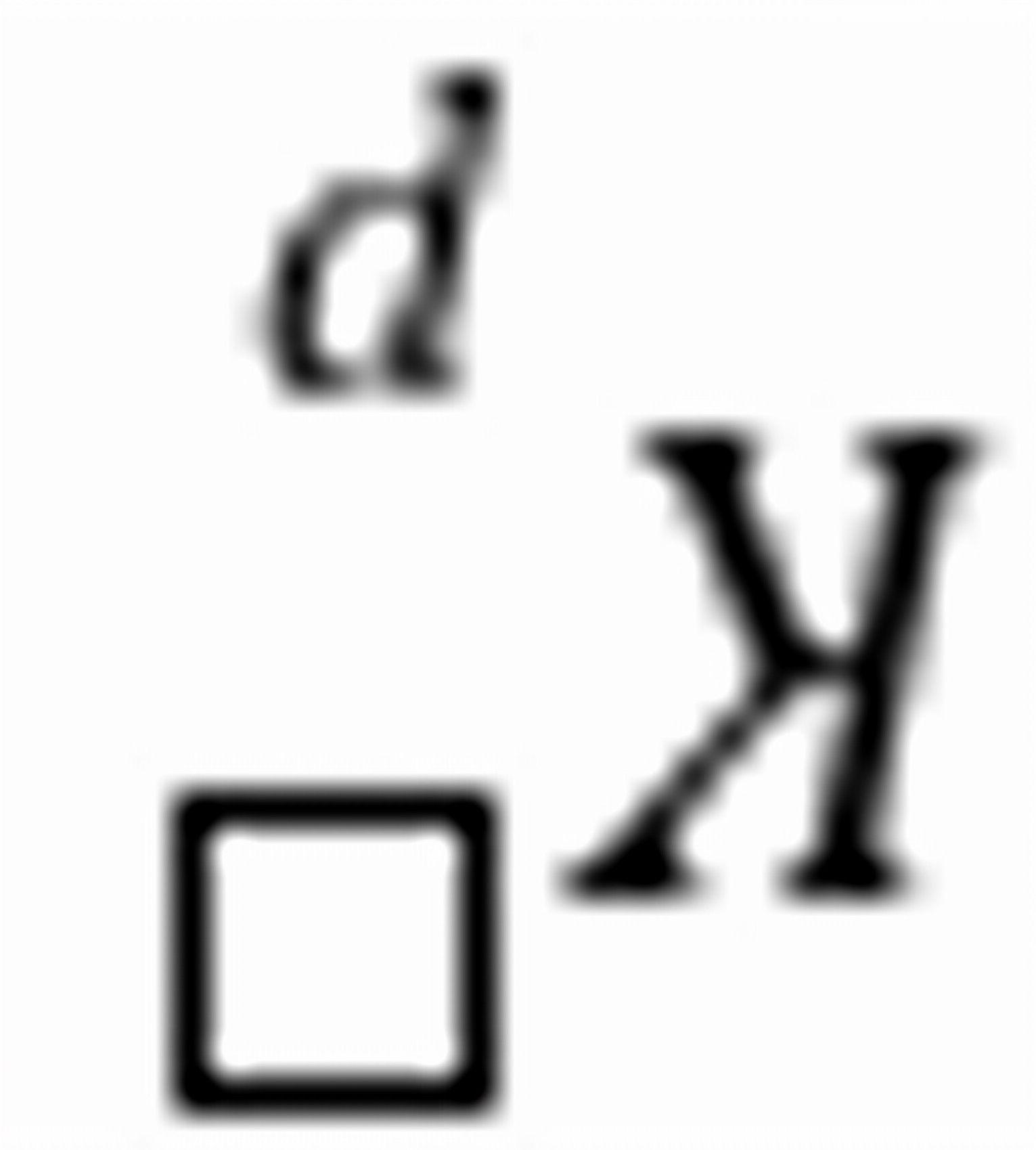
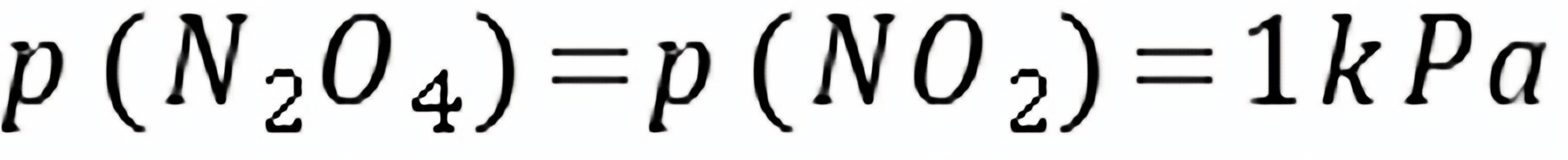 ,
,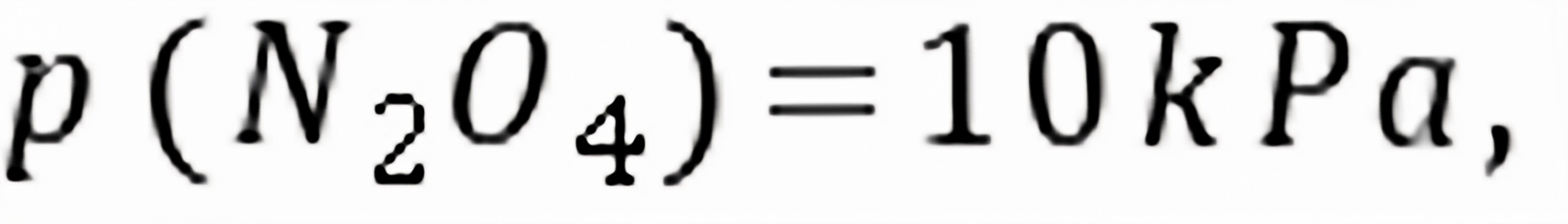 。________;________。
。________;________。
练习6.10标准平衡常数与经验平衡常数的区别是。
练习6.11298.15 K时,平衡C6H6(l)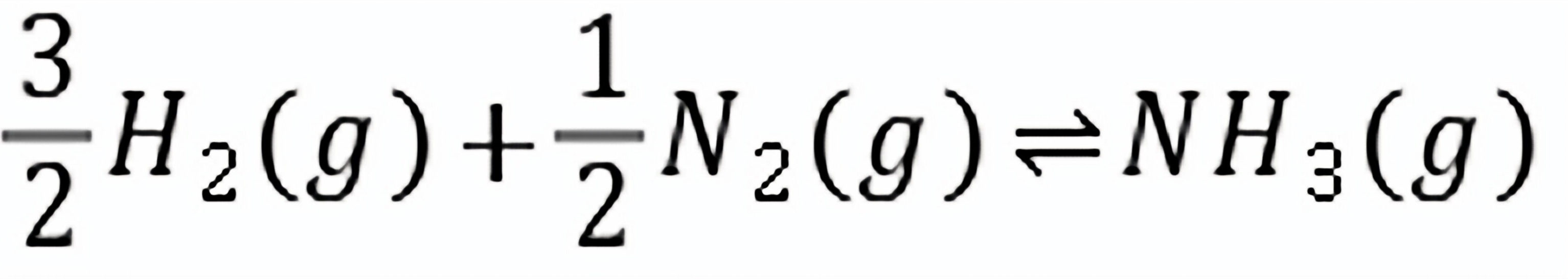 C6H6(g)的平衡常数,298.15 K时苯的蒸汽压。(已知苯的正常沸点为80.15℃,它在10℃时的蒸汽压为5.96 kPa。)
C6H6(g)的平衡常数,298.15 K时苯的蒸汽压。(已知苯的正常沸点为80.15℃,它在10℃时的蒸汽压为5.96 kPa。)
讨论6-2 Vant Hoff等温方程有两种形式,哪种形式更严格?二者之间的差异如何?
练习6.12 在温度T,压力p时,理想气体反应的平衡常数比值为。
练习6.13 对于理想气体间反应,以各种形式表示的平衡常数中,其值与温度和压力皆有关系的是。
练习6.14已知化学反应为,试证明该反应的。
练习6.15合成氨反应为3H2(g)+N2(g)2NH3(g),所用反应物氢气和氮气的摩尔比为3:1,在673 K、1000 kPa压力下达成平衡,平衡产物中氨的摩尔分数为0.0385。试求:该反应在该条件下的标准平衡常数。
练习6.16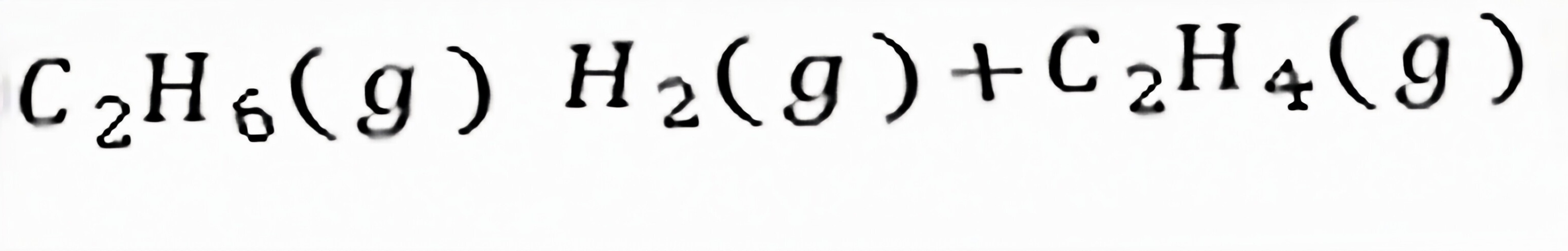 与
与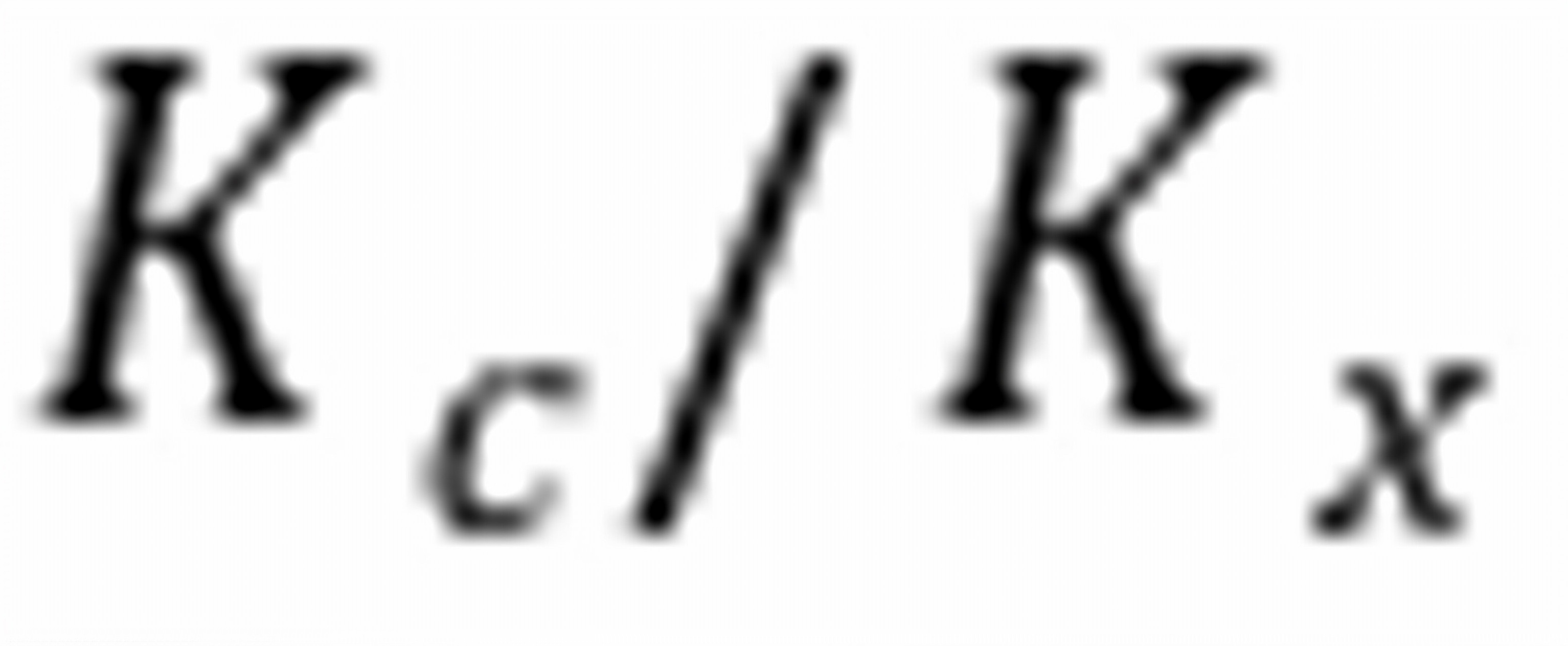 、、的区别是。
、、的区别是。
讨论6-3 标准平衡常数是如何定义的?它与平衡时的压力和浓度关系是不是标准平衡常数的定义式?它们的等式关系是否绝对成立?如果不成立,其差异何在?
练习6.17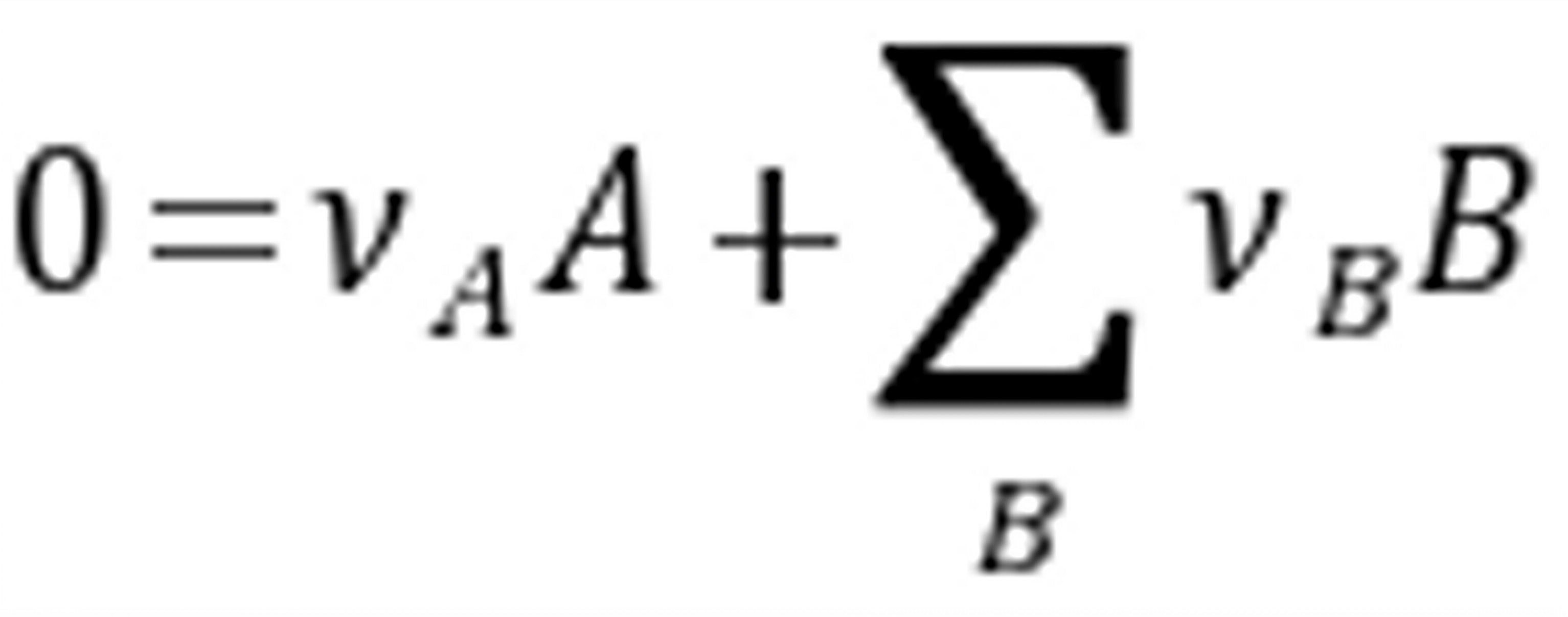 与平衡的压力的关系式中只出现气相的物质压力原因是。
与平衡的压力的关系式中只出现气相的物质压力原因是。
练习6.18分解压是,解离压是,分解压和解离压的区别和联系是。
练习6.19设某分解反应为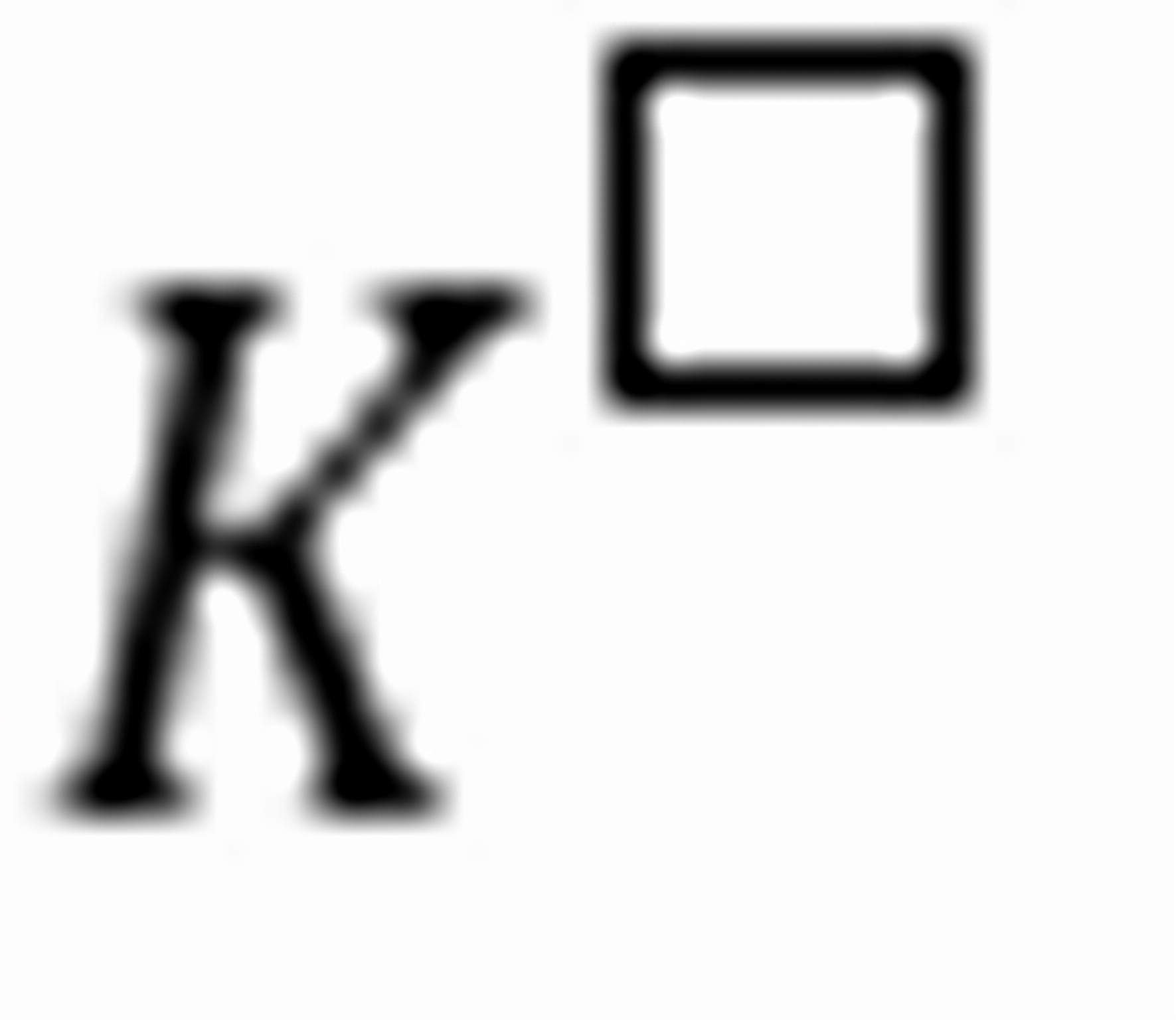 ,若某平衡常数和解离压力分别为
,若某平衡常数和解离压力分别为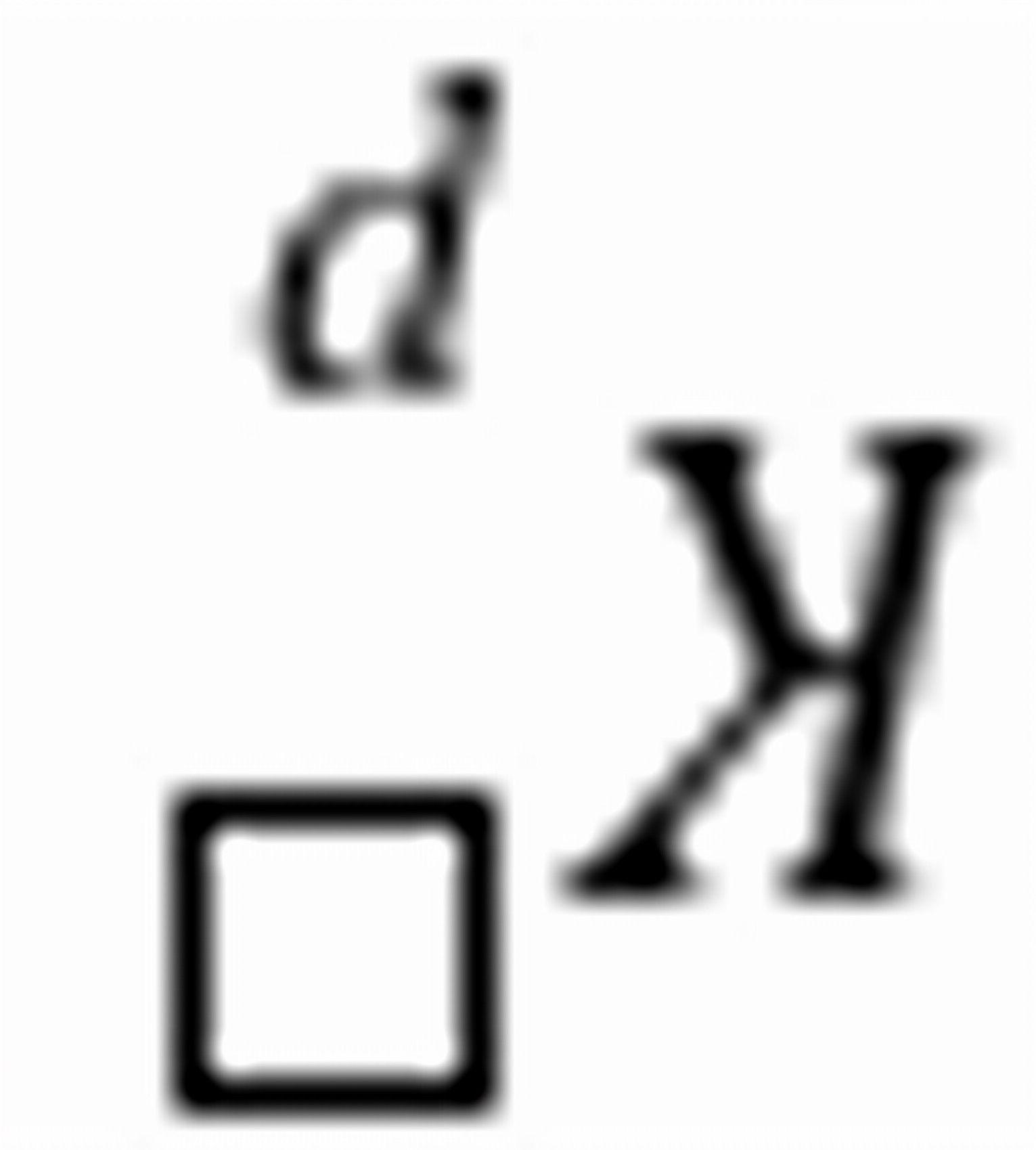 ,p,写出平衡常数与解离压力的关系式。
,p,写出平衡常数与解离压力的关系式。
练习6.20373 K时,反应的。(1)在的抽空容器中,放入0.1 mol,并通入0.2 mol,问最少需通入物质的量为多少的,才能使全部转化成?(2)在373 K,总压为101 325 Pa 时,要在及的混合气体中干燥潮湿的,问混合气体中的分压应为多少才不致使分解?
讨论6-4对于纯固相的反应有没有平衡问题?它们与纯物质之间有没有平衡常数的浓度表达式?
练习6.21试估计能否像炼铁那样,直接用碳来还原TiO2(s),TiO2(s)+C(s) =Ti(s)+CO2( g)
已知:,
练习6.22化学反应等温式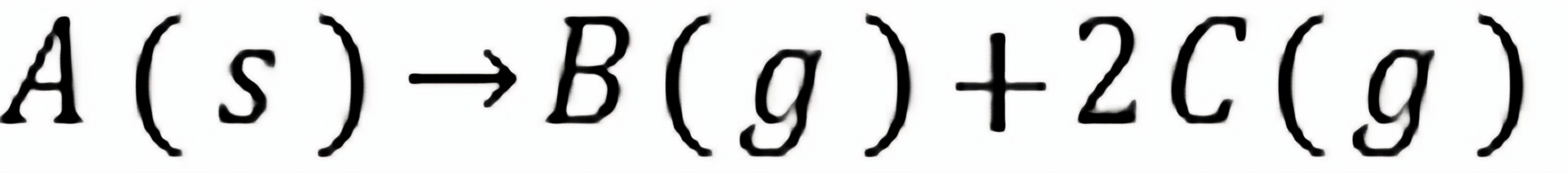 ,当选取不同标准态时,反应的
,当选取不同标准态时,反应的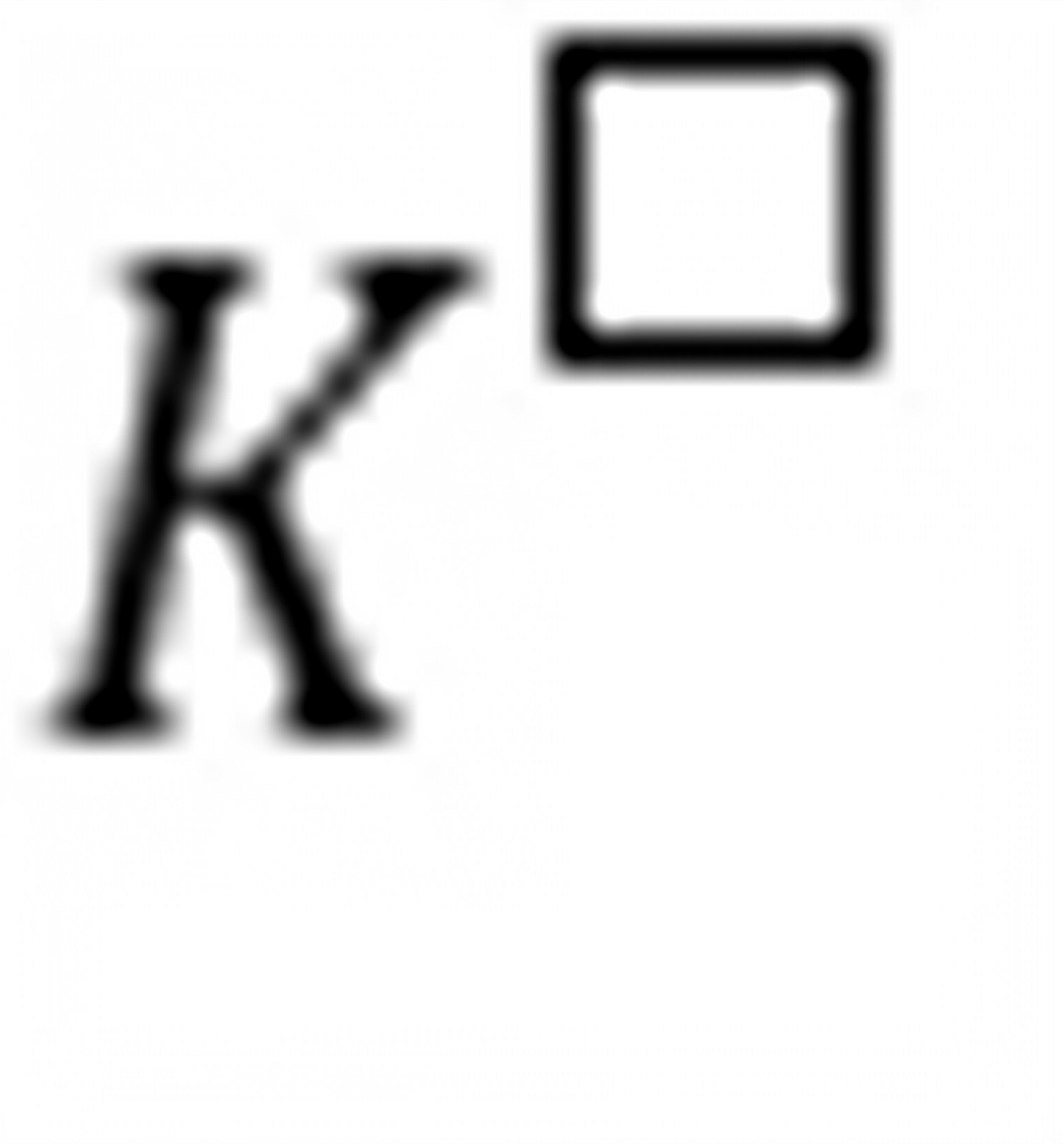 将和。
将和。
练习6.23已知298.15 K,水蒸气的标准摩尔生成吉布斯函数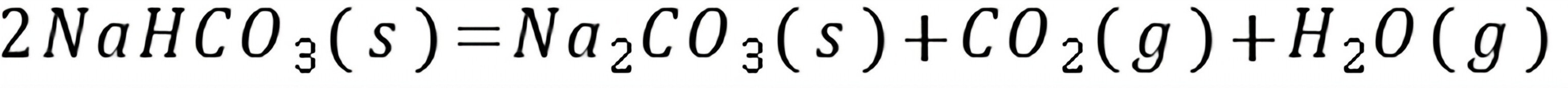 (H2O,g)=-228.572 kJmol1。在同样的温度下,反应2H2O(g)
(H2O,g)=-228.572 kJmol1。在同样的温度下,反应2H2O(g)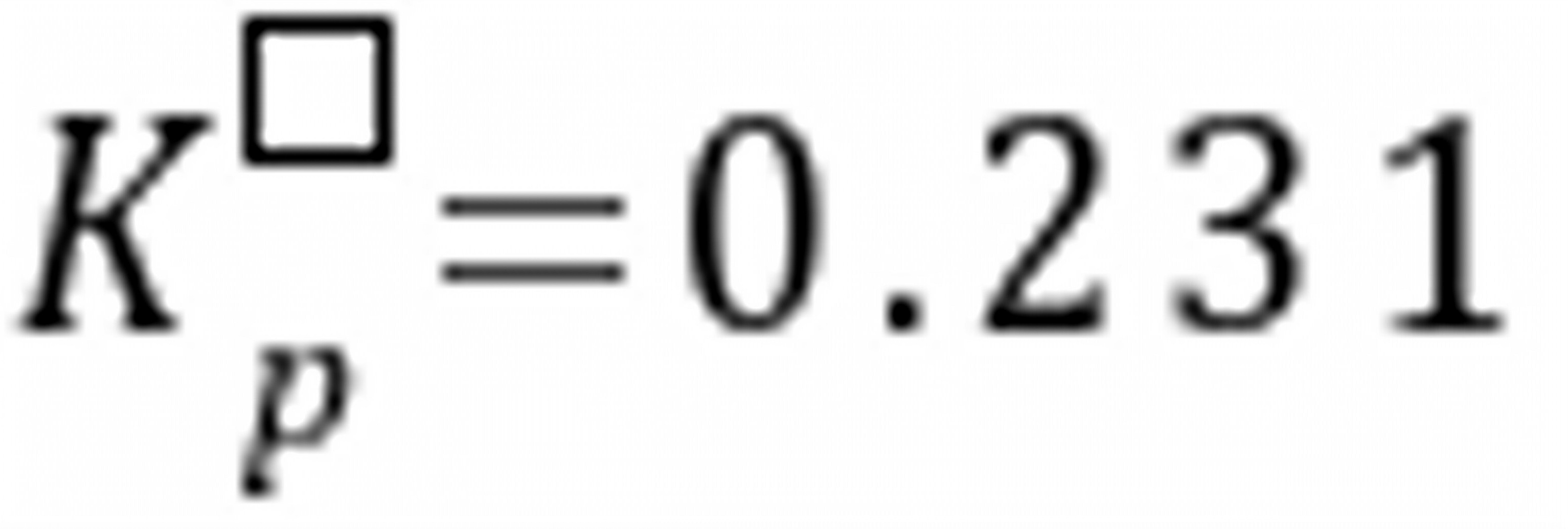 2H2(g)+O2(g)的标准平衡常数
2H2(g)+O2(g)的标准平衡常数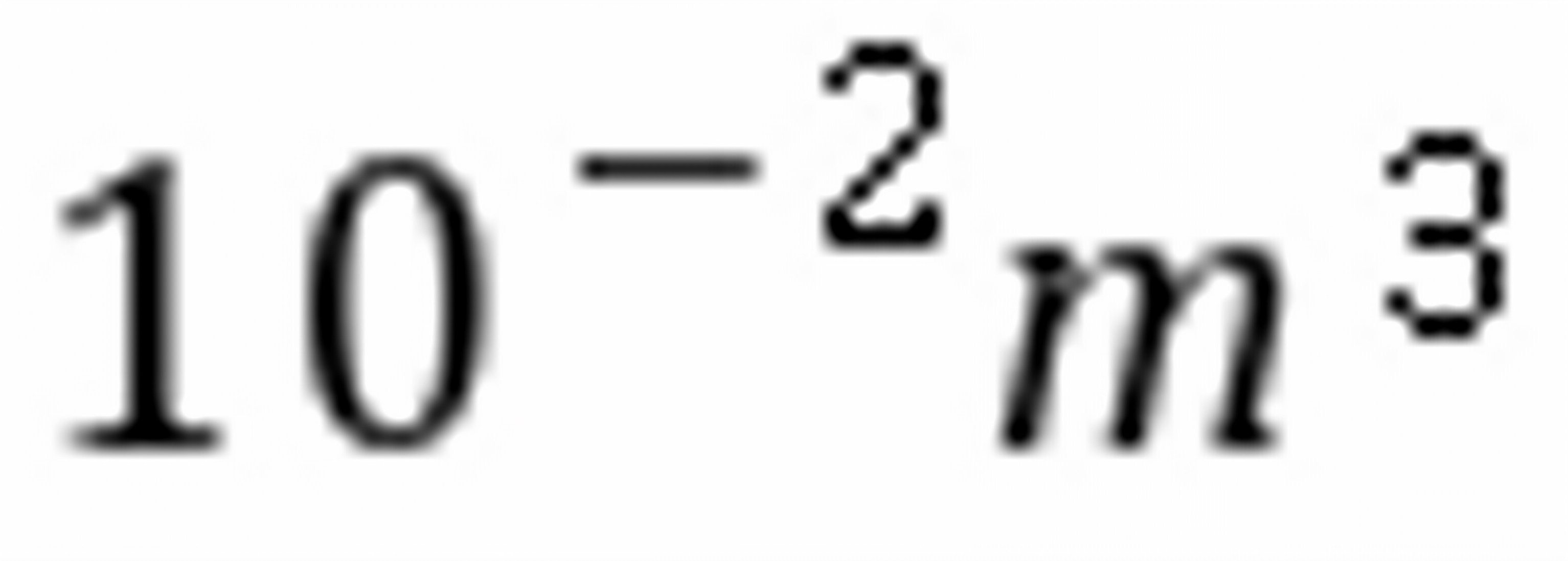 =。
=。
练习6.24NH3(g)制备HNO3的一种工业方法,是将NH3(g)与空气的混合物通过高温下的金属Pt催化剂,主要反应为4NH3(g)+5O2(g)4NO(g)+6H2O(g)。试计算1073K时的标准平衡常数。设反应的不随温度而改变,所需要热力学数据从附录查询。
练习6.25已知下列氧化物的标准生成自由能与温度的关系为:
,
(1)试用计算说明在0.133Pa的真空条件下,用碳粉还原固态MnO生成纯Mn及CO(g)的最低还原温度是多少?
(2)在(1)的条件下,用计算说明还原反应能否按下列方程式进行?MnO(s)+C(s)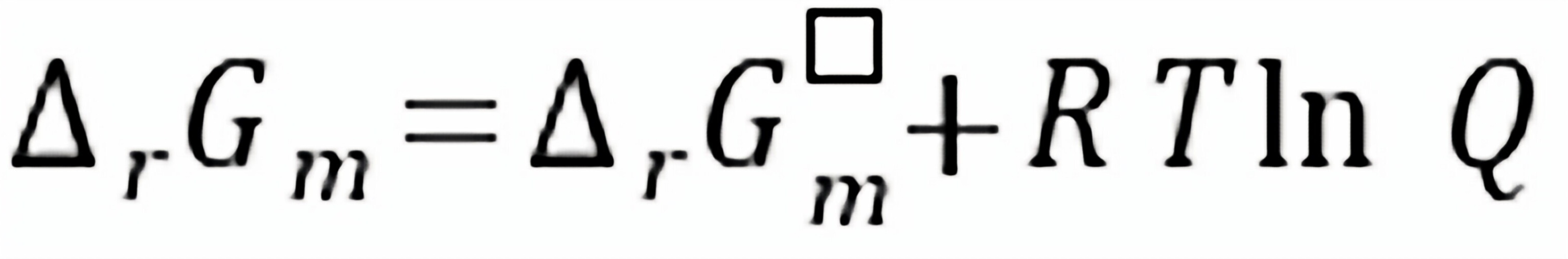 2 Mn(s)+ CO2(g)
2 Mn(s)+ CO2(g)
.
讨论6-5 用 判断反应方向的前提条件是什么?
判断反应方向的前提条件是什么?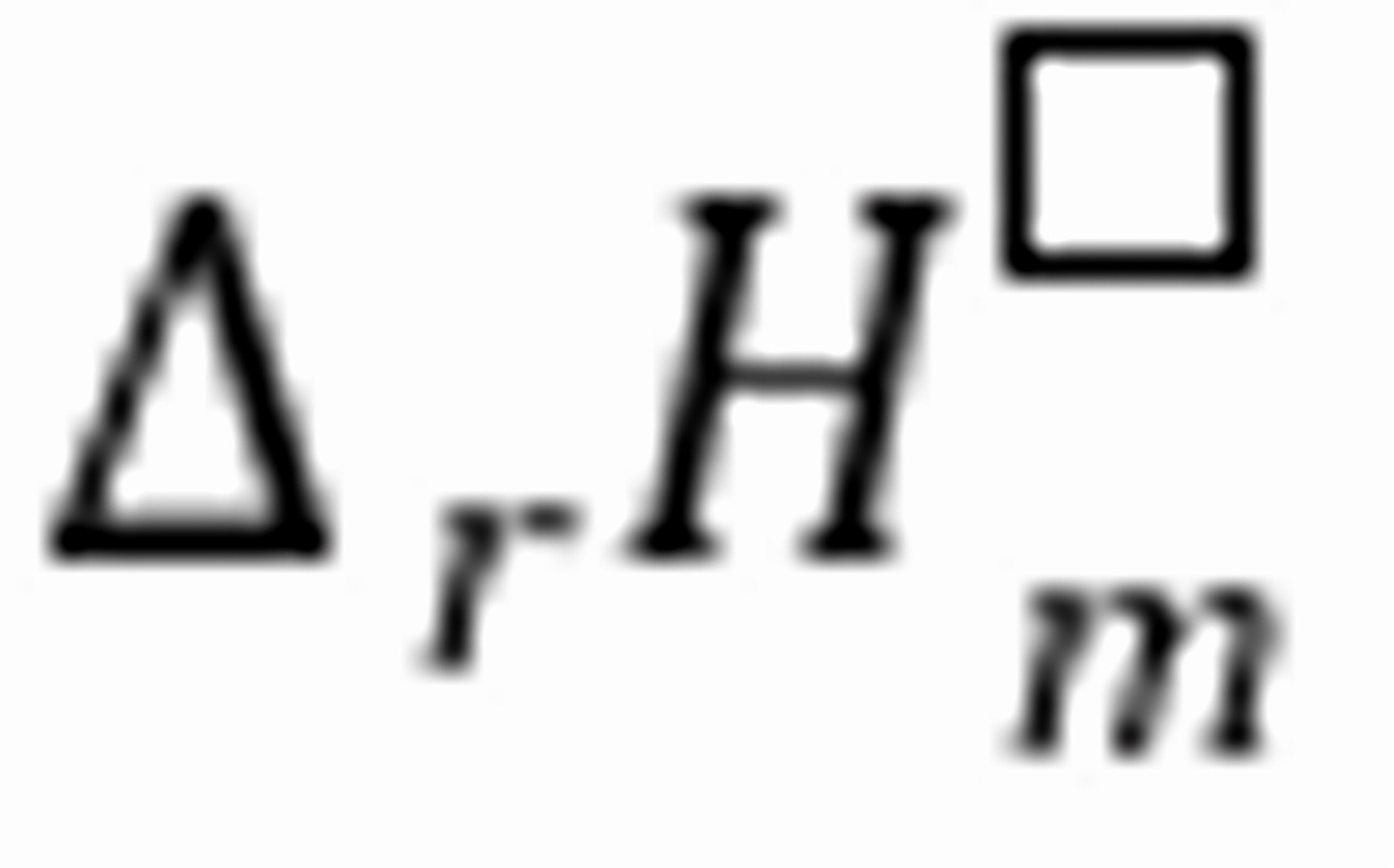 的计算有几种方法?Ellingham 图有何用途?
的计算有几种方法?Ellingham 图有何用途?
练习6.26对于实际气体温度对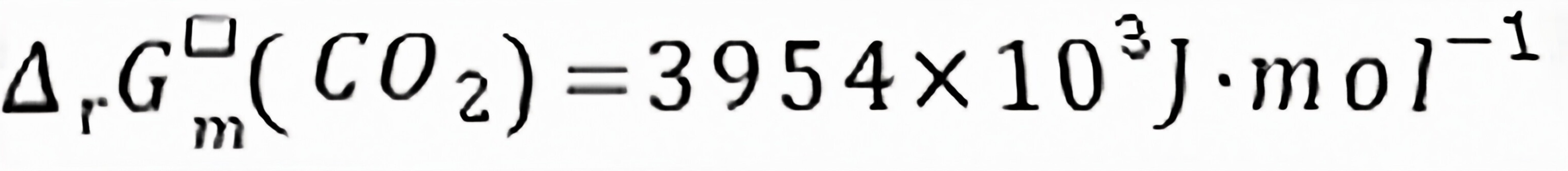 的影响是,对的随温度的变化趋势是。
的影响是,对的随温度的变化趋势是。
练习6.27已知FeO(s)+C(s)=CO(g)+Fe(s),反应的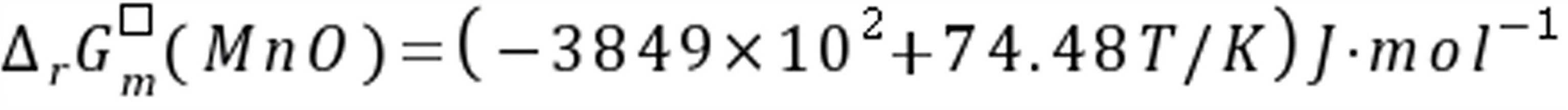 为正,(设
为正,(设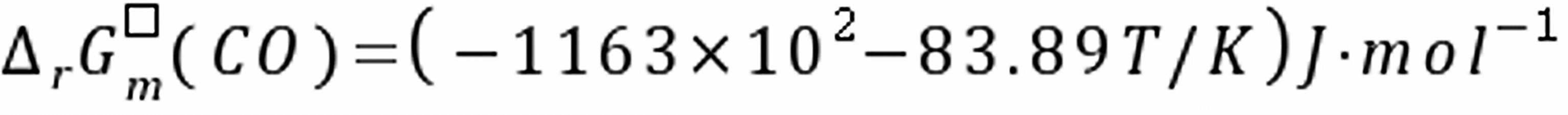 随温度而变化),欲使反应正向进行,则有利。
随温度而变化),欲使反应正向进行,则有利。
练习6.28某反应的与T的关系为/(Jmol1)=83.145T/K-0.83145,则此反应的=。
练习6.29实际气体反应CO(g)+H2O(g)=CO2(g)+H2(g)在873 K、100 kPa下达化学平衡,当压力增至5000 kPa时,各气体的逸度系数为: ,,,,=,变,则平衡点将移动。
,,,,=,变,则平衡点将移动。
练习6.30对于理想气体反应CH4(g) + 2O2(g)CO2(g) + 2H2O(g),在恒温下,增加反应系统的总压力,而使系统的体积变小,这时。
练习6.31在刚性密闭容器中,有下列理想气体反应达平衡A(g)+B(g)=C(g),若在恒温下加入一定量惰性气体,则平衡将。
练习6.32在T=380 K,总压p=2.00 kPa下,反应C6H5C2H5(g)C6H5C2H3(g) +H2(g)的平衡系统中,加入一定量的惰性组分H2O(g),则反应的标准平衡常数;C6H5C2H5(g)的平衡转化率;C6H5C2H3(g)的摩尔分数。
讨论6-6 温度、压力、浓度和惰性气体对化学平衡移动的影响体现在哪几个方面?
练习6.33甲烷,水蒸气为15的混合气体,在600℃,101.325 MPa下通过催化剂,以生产合成氨用的氢气。设同时发生如下反应:CH4(g)+H2O(g) → CO(g)+3H2(g)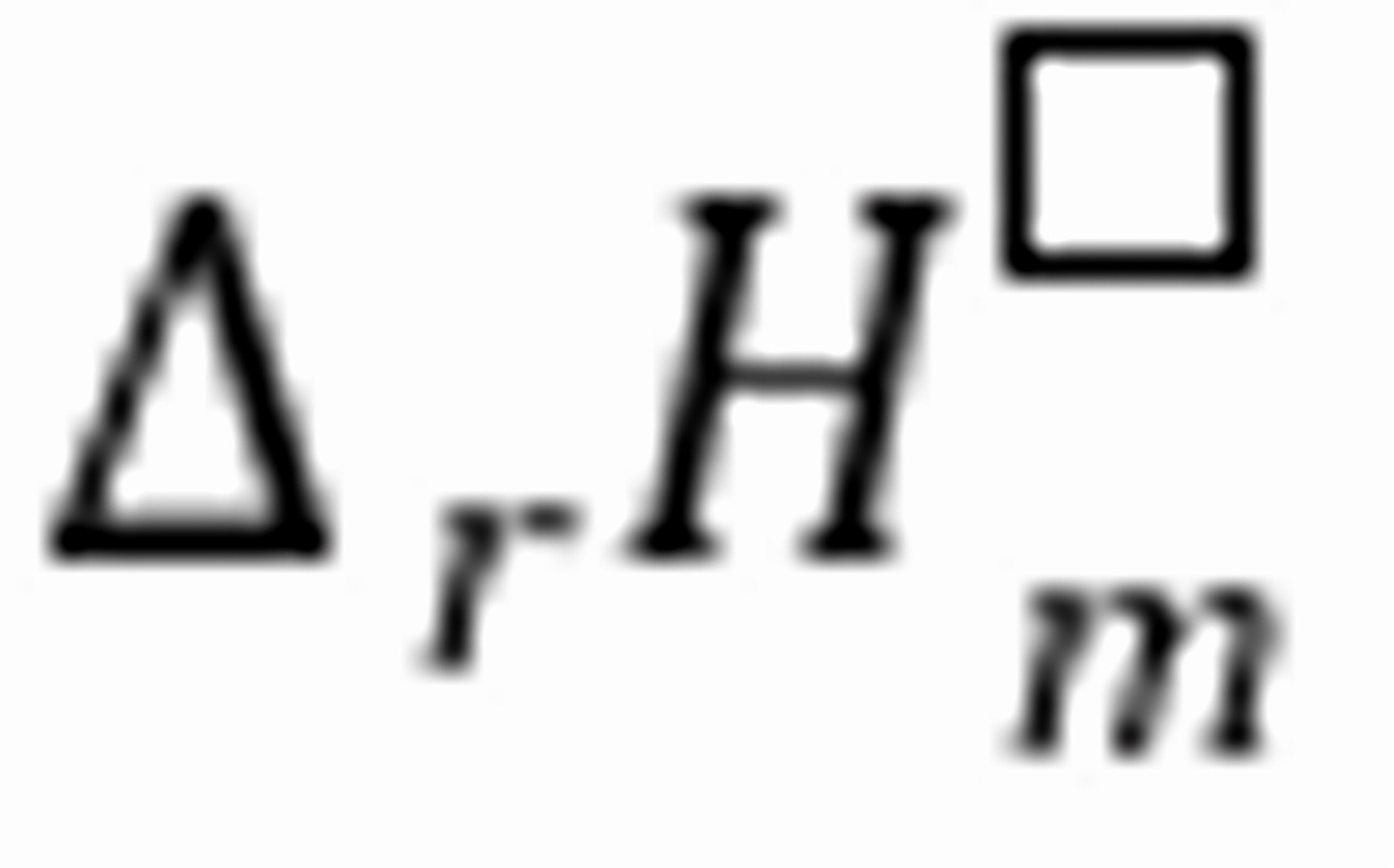 ,CO(g)+H2O(g) → CO2(g)+H2(g)
,CO(g)+H2O(g) → CO2(g)+H2(g)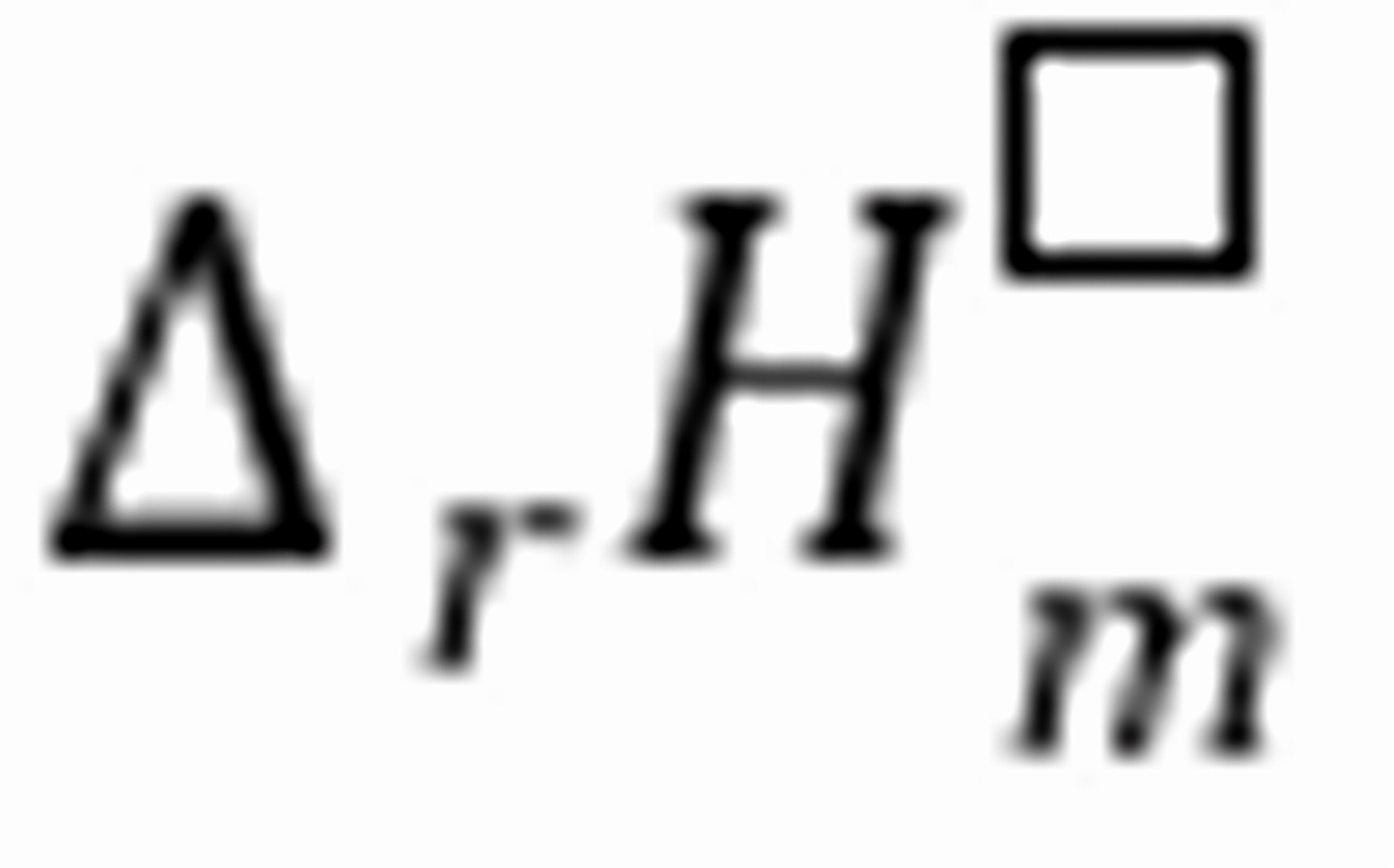 ,求平衡组成。
,求平衡组成。
练习6.34已知反应 (1)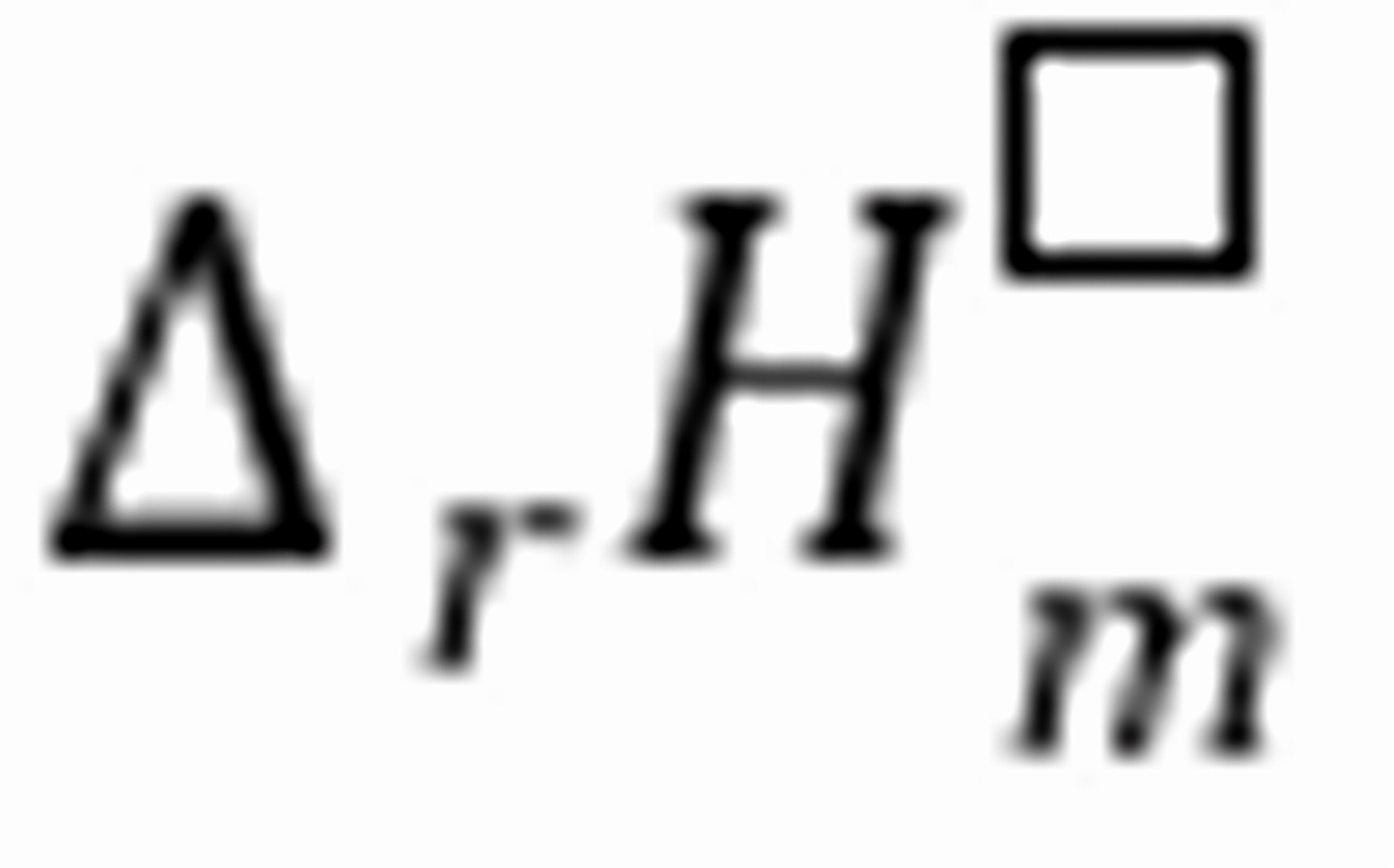
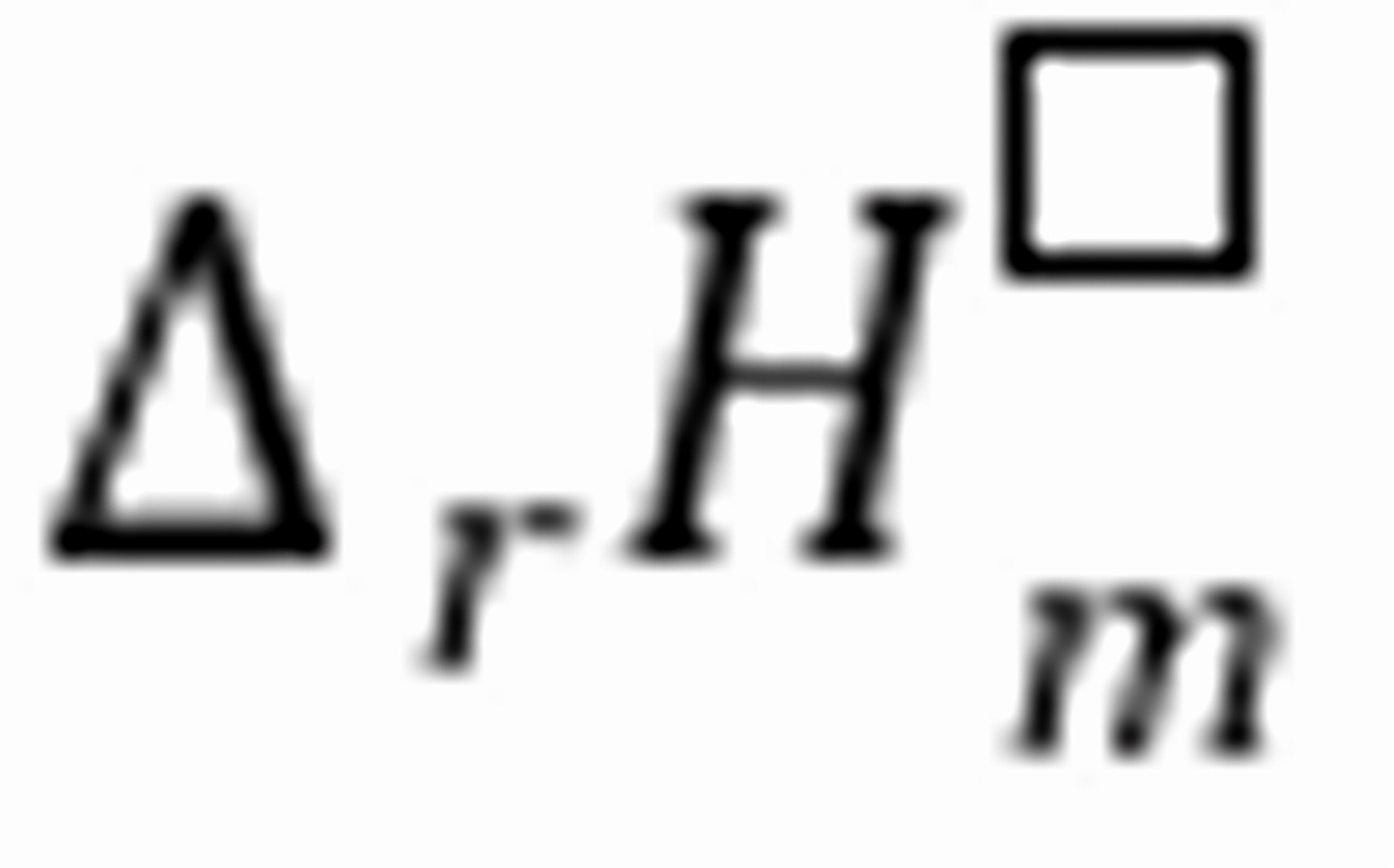
(2)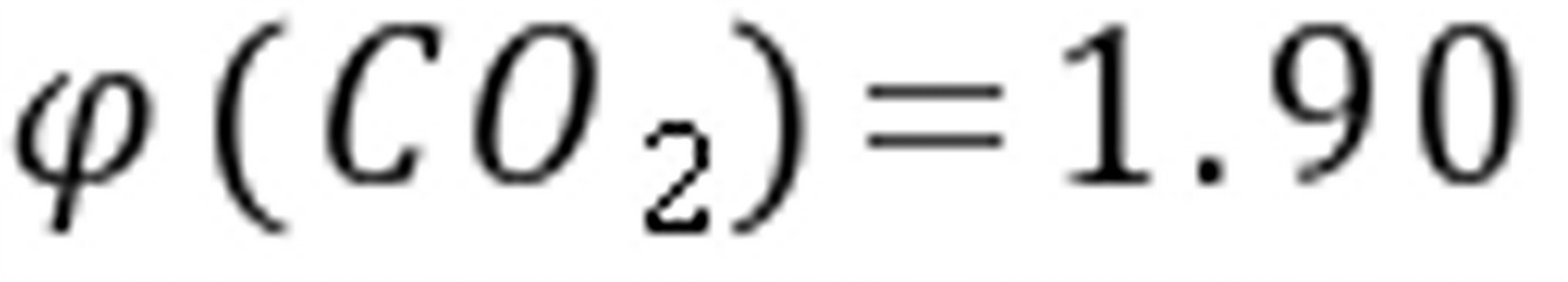
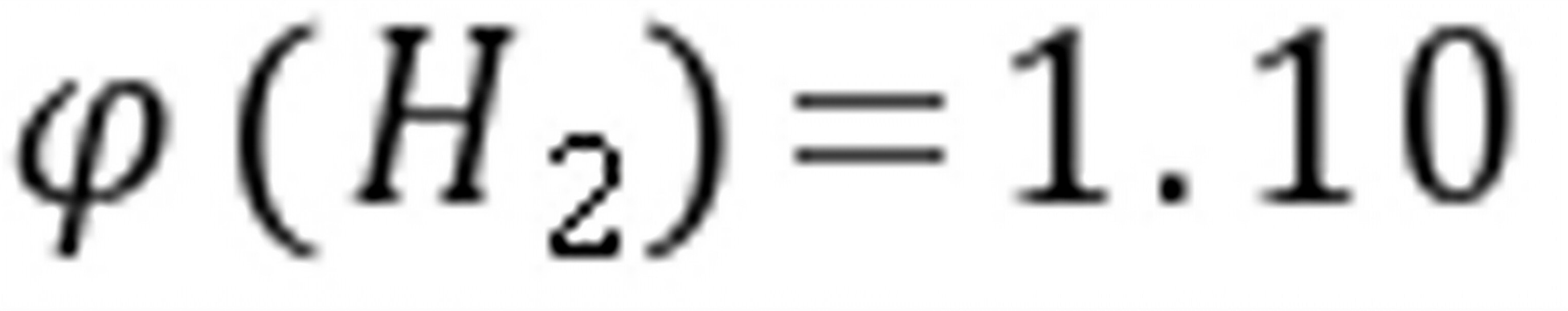
试回答:(a)在298 K,当,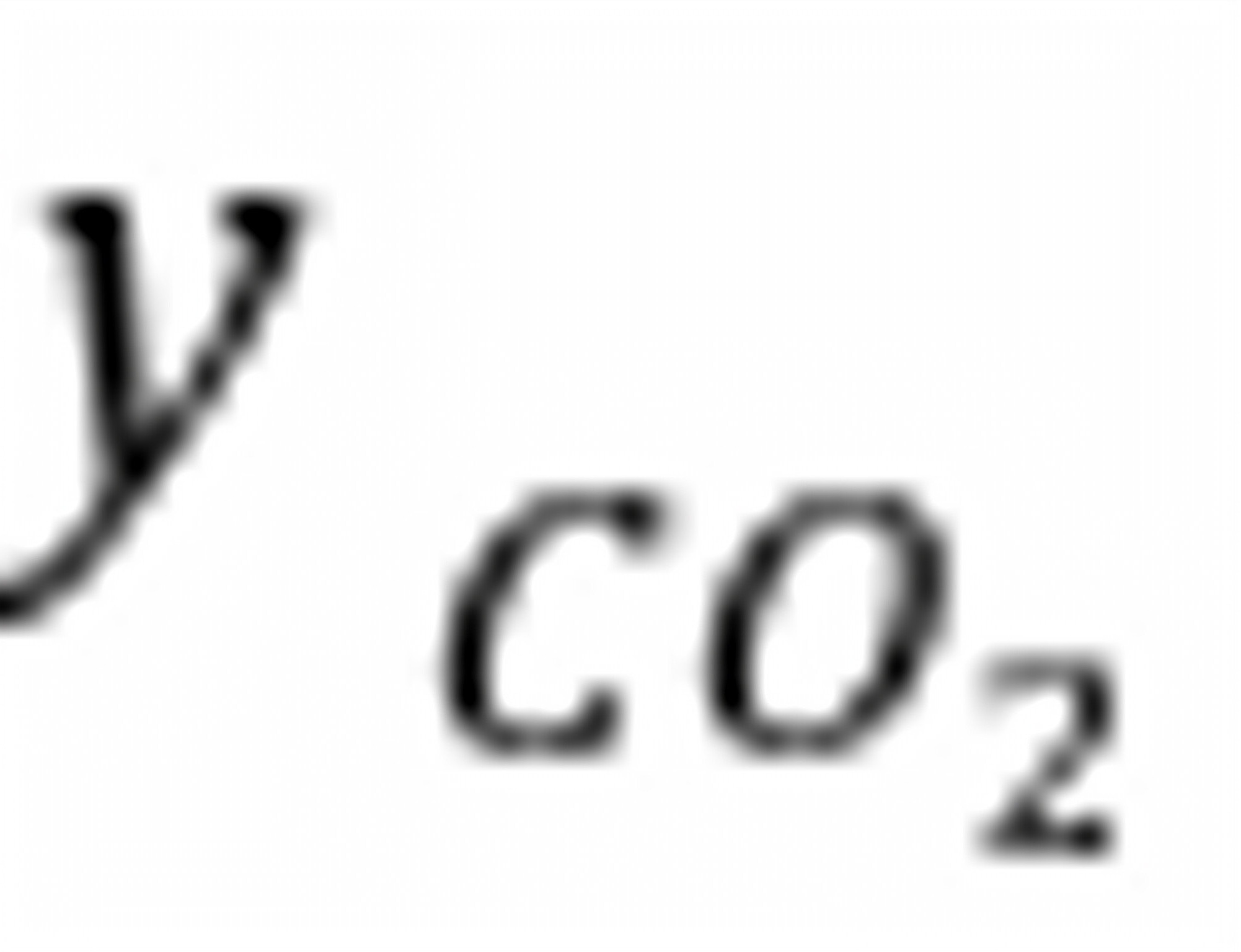 和平衡共存时的是多少?
和平衡共存时的是多少?
(b)当,欲使三者平衡共存,需T为多少?若T超过此值,物相将发生何种变化?
讨论6-7 在同时平衡的反应系统计算中,主要需要考虑的是什么?
练习6.35反应Fe2O3(s)+2CO(g)2Fe(s)+3CO2(g),在不同温度时的如下:
在1393.15 K时,反应2 CO2(g)2CO(g)+O2(g)的为1.4×10-12,则在1393.15 K时,在含有Fe2O3的容器中,O2的分压应该多大才能阻止Fe2O3变为Fe?
练习6.36在723K时,将0.10molH2(g)和0.20molCO2(g)通入抽空的瓶中,发生如下的反应:(1) H2(g)+ CO2(g) =CO(g)+ H2O(g),平衡后瓶中的总压为50.66 kPa,经分析知共中水蒸气的摩尔分数为0.10。今在容器中加入过量的氧化钴CoO(s)和金属钴,在容器中又增加了如下两个反应:(2) CoO(s)+ H2(g) = Co(s)+ H2O(g);(3) CoO(s)+ CO(g) =Co(s)+ CO2(g)。经分析知容器中的水蒸气的摩尔分数为0.30.试分别计算这三个反应用摩尔分数表示的平衡常数。
讨论6-8 耦合反应和同时平衡反应有无区别?耦合反应的真正用途是什么?
练习6.37在T=600 K,总压p=3×105Pa下,反应A(g)+B(g)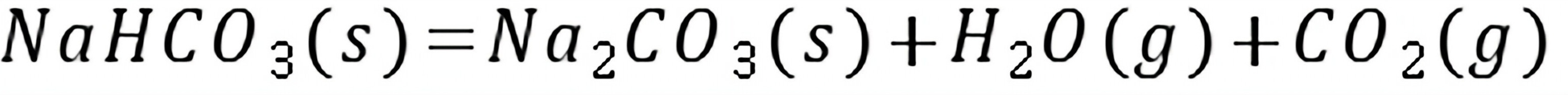 2D(g)达平衡时,各气体物质的量之比为nA/nB=nB/nD=1,则此反应的
2D(g)达平衡时,各气体物质的量之比为nA/nB=nB/nD=1,则此反应的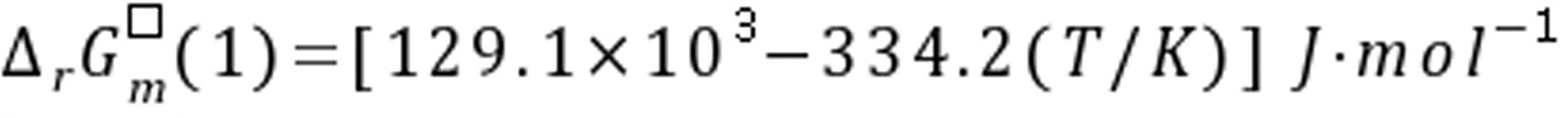 =();=();=()。
=();=();=()。
练习6.3825℃时,水的饱和蒸汽压为3.168kPa,此时液态水的标准摩尔生成Gibbs自由能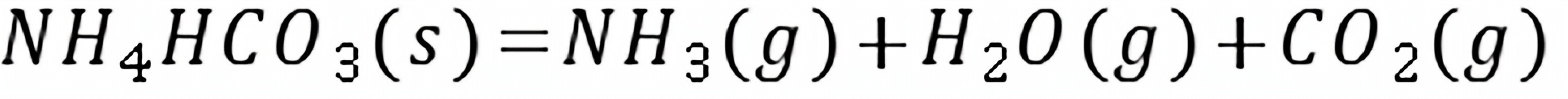 ,则水蒸气的标准摩尔生成Gibbs自由能为________________。
,则水蒸气的标准摩尔生成Gibbs自由能为________________。
练习6.39用空气和甲醇蒸气通过银催化剂制备甲醛,在反应过程中银逐渐失去光泽,并且有丝碎裂。试根据下列数据,说明在823K和气体压力为100kPa的反应条件下,银催化剂是否有可能被氧化为氧化银。已知Ag2O(s)的: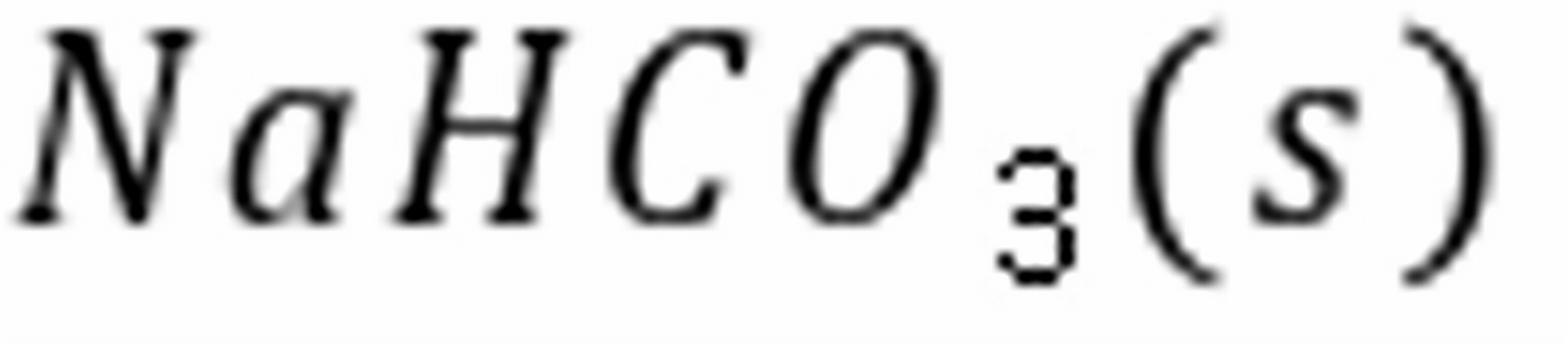 ,
,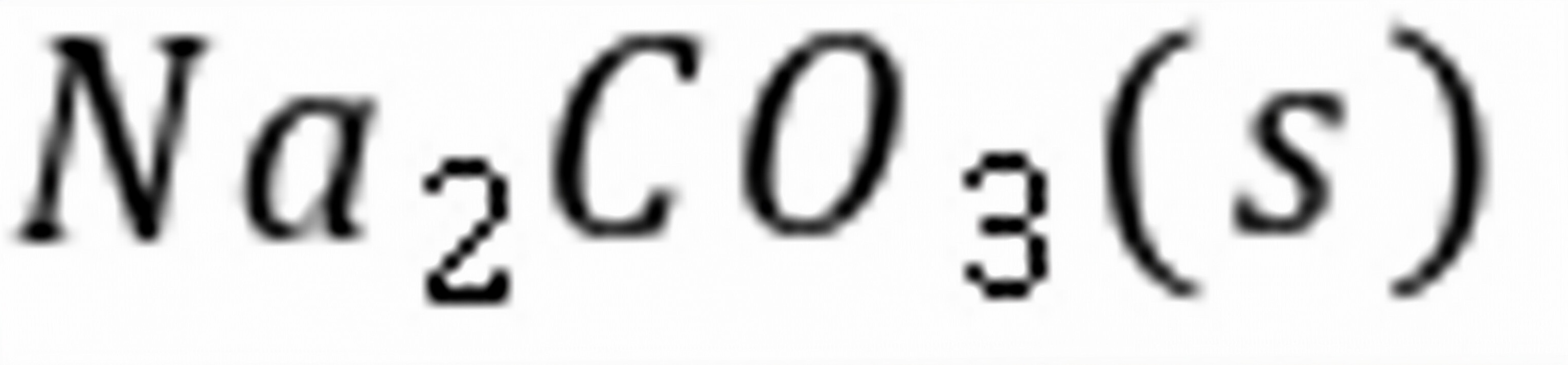 。O2(g),Ag2O(s),Ag(s)在298~823K的温度区间内的平均定压比热容分别为:29.36,65.86,25.35 Jmol1K1。
。O2(g),Ag2O(s),Ag(s)在298~823K的温度区间内的平均定压比热容分别为:29.36,65.86,25.35 Jmol1K1。
练习6.40反应2Ca(l)+ThO2(s)2CaO(s)+Th(s),在1373K时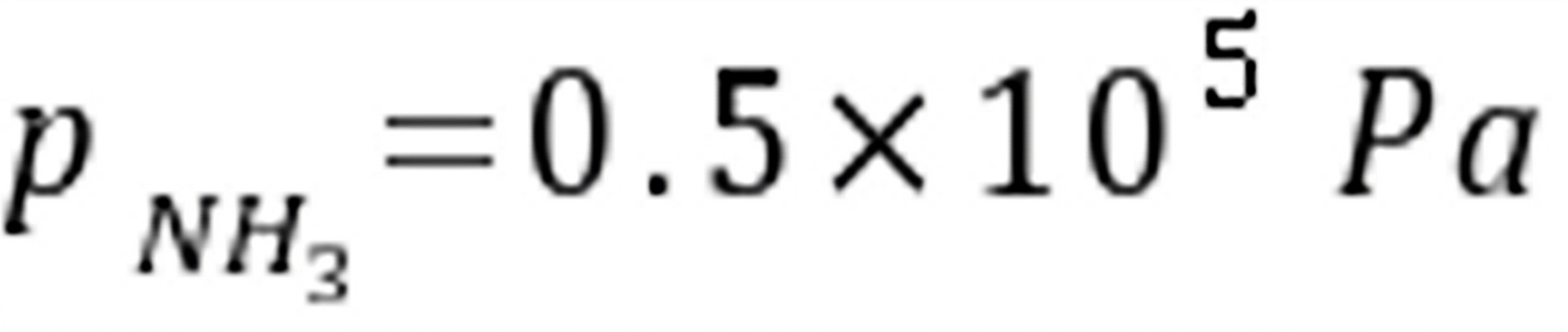 kJmol1,在1473K时kJmol1,试估计Ca(l)能还原ThO2(s)的最高温度T为。
kJmol1,在1473K时kJmol1,试估计Ca(l)能还原ThO2(s)的最高温度T为。
练习6.41两种硫化汞晶体转换反应:,转换反应的标准Gibbs自由能的变化值与温度的关系为:。(1)问在373K时,哪一种硫化汞晶体较为稳定?(2)求该反应的转换温度.
练习6.42已知有关氧化物的标准生成自由能为:
, 。试计算:
。试计算:
(1)在0.13333 Pa的真空条件下,用炭粉还原固态MnO生成纯Mn及CO的最低还原点温度是多少?
(2)在(1)的条件下还原反应能否按下列方程式进行?
讨论6-9 估算和反应的转折温度时产生的误差来源哪些方面?
§4.10复习总结自测与提高
题目解答
答案
= = __ __