试用计算说明向CuSO4溶液中加入KI是否会产生白色沉淀?并计算下列反应的平衡常数:2Cu2+ +4I- = 2CuI +I2(已知:φy(Cu2+/Cu+) = 0.158 V; φy(I2/I-) = 0.537V;Ksp (CuI) =1.2710-12)
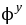 (Cu2+/Cu+) = 0.158 V;
(Cu2+/Cu+) = 0.158 V; 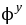 (I2/I-) = 0.537V;
(I2/I-) = 0.537V;题目解答
答案
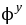 (Cu2+/CuI) = 0.158 - log1.2710-12 = 0.862 V
(Cu2+/CuI) = 0.158 - log1.2710-12 = 0.862 V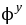 (I2/I-) = 0.537V
(I2/I-) = 0.537V解析
考查要点:本题主要考查氧化还原反应的方向判断及平衡常数的计算,涉及电极电位、溶度积的应用以及利用电化学数据计算平衡常数。
解题核心思路:
- 判断反应方向:通过比较调整后的氧化剂和还原剂的电极电位,确定反应是否自发进行。
- 溶度积的影响:Cu²⁺与I⁻反应生成CuI沉淀时,溶度积决定了反应的进行程度。
- 平衡常数计算:利用标准电极电位差与平衡常数的关系式,结合电子转移数,计算反应的平衡常数。
破题关键点:
- 调整Cu²⁺的电极电位:考虑CuI的溶度积对Cu²⁺实际电位的影响。
- 比较电位差:判断反应的自发性。
- 公式转换:将电位差转化为平衡常数,注意单位和计算步骤。
判断是否生成沉淀
-
调整Cu²⁺的电极电位
Cu²⁺与I⁻反应生成CuI(s),其反应为:
$\text{Cu}^{2+} + e^- \rightarrow \text{CuI(s)}$
根据能斯特方程,调整后的电极电位为:
$\phi_{\text{Cu}^{2+}/\text{CuI}} = \phi^\circ_{\text{Cu}^{2+}/\text{Cu}^+} + \frac{0.0592}{1} \log \frac{1}{[\text{Cu}^{2+}][\text{I}^-]}$
由于$[\text{Cu}^{2+}][\text{I}^-] = K_{sp}(\text{CuI}) = 1.27 \times 10^{-12}$,代入得:
$\phi_{\text{Cu}^{2+}/\text{CuI}} = 0.158 \, \text{V} + 0.0592 \times \log \frac{1}{1.27 \times 10^{-12}} \approx 0.862 \, \text{V}$ -
比较电位差
- 调整后的$\phi_{\text{Cu}^{2+}/\text{CuI}} = 0.862 \, \text{V}$(氧化剂的还原电位)
- $\phi_{\text{I}_2/\text{I}^-} = 0.537 \, \text{V}$(还原剂的氧化电位)
由于$0.862 \, \text{V} > 0.537 \, \text{V}$,反应自发进行,生成CuI沉淀。
计算平衡常数
-
确定标准电动势
$\Delta \phi = \phi_{\text{cathode}} - \phi_{\text{anode}} = 0.862 \, \text{V} - 0.537 \, \text{V} = 0.325 \, \text{V}$ -
计算平衡常数
根据公式$\log K = \frac{n \Delta \phi}{0.0592}$,其中$n = 2$(反应中转移2对电子):
$\log K = \frac{2 \times 0.325}{0.0592} \approx 10.98 \quad \Rightarrow \quad K = 10^{10.98} \approx 9.54 \times 10^{10}$