题目
中南大学郑雅杰等3位老师提出“以含砷废水沉淀还原法制备As2O3”,有较高的实际应用价值。某工厂含砷废水含有H3AsO3、H2SO4、Fe2(SO4)3、Bi2(SO4)3等,利用该废水提取As2O3的流程如图1所示。NaOH,调节pH为6 ①过量CuSO4 水-|||-含砷废水 中和 滤液1 过滤 Cu,(AsO4)2沉淀 -S(O)_(2)-|||-沉淀1 ②NaOH,调节pH为8 过滤-|||-As2O, 干燥 蒸发浓缩、冷却结晶 H,AsO,溶液 Cu1(SO,)2·2H2O 氧化 A-|||-图1 离子浓度(mol/L)开始沉淀pH离子 10-1 10-2 10-3 10-4 10-5 Fe3+ 1.9 2.2 2.5 2.9 3.2 Cu2+ 4.7 5.2 5.7 6.2 6.7 (1)为了加快中和过程的速率,可以采取的措施有 ____ (写出一条合理的措施即可)。(2)沉淀Ⅰ中的成分,除了Bi(OH)3沉淀外,还有 ____ 。(3)A可以循环利用,A的化学式为 ____ 。在滤液1中,加入NaOH调节pH为8的目的是 ____ 。(4)Cu3(AsO3)2沉淀加入一定量的水调成浆料,通入SO2,该过程的化学反应方程式是 ____ 。(5)按照一定的液固比,将水加入Cu3(AsO3)2沉淀中,调成浆料。当反应温度为25℃,SO2流量为16L/h,液固比、时间对砷、铜浸出率的影响如图2甲、乙所示。请选择最适宜的液固比、反应时间: ____ 、 ____ 。NaOH,调节pH为6 ①过量CuSO4 水-|||-含砷废水 中和 滤液1 过滤 Cu,(AsO4)2沉淀 -S(O)_(2)-|||-沉淀1 ②NaOH,调节pH为8 过滤-|||-As2O, 干燥 蒸发浓缩、冷却结晶 H,AsO,溶液 Cu1(SO,)2·2H2O 氧化 A-|||-图1(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图3所示。若反应中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mol e-,则物质a为 ____ (填化学式)。
中南大学郑雅杰等3位老师提出“以含砷废水沉淀还原法制备As2O3”,有较高的实际应用价值。某工厂含砷废水含有H3AsO3、H2SO4、Fe2(SO4)3、Bi2(SO4)3等,利用该废水提取As2O3的流程如图1所示。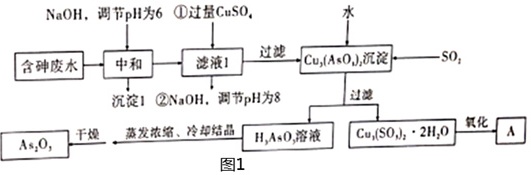
(1)为了加快中和过程的速率,可以采取的措施有 ____ (写出一条合理的措施即可)。
(2)沉淀Ⅰ中的成分,除了Bi(OH)3沉淀外,还有 ____ 。
(3)A可以循环利用,A的化学式为 ____ 。在滤液1中,加入NaOH调节pH为8的目的是 ____ 。
(4)Cu3(AsO3)2沉淀加入一定量的水调成浆料,通入SO2,该过程的化学反应方程式是 ____ 。
(5)按照一定的液固比,将水加入Cu3(AsO3)2沉淀中,调成浆料。当反应温度为25℃,SO2流量为16L/h,液固比、时间对砷、铜浸出率的影响如图2甲、乙所示。请选择最适宜的液固比、反应时间: ____ 、 ____ 。
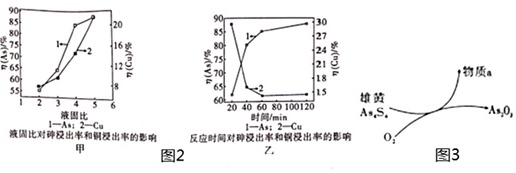
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图3所示。若反应中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mol e-,则物质a为 ____ (填化学式)。

| 离子浓度(mol/L) 开始沉淀pH 离子 |
10-1 | 10-2 | 10-3 | 10-4 | 10-5 |
| Fe3+ | 1.9 | 2.2 | 2.5 | 2.9 | 3.2 |
| Cu2+ | 4.7 | 5.2 | 5.7 | 6.2 | 6.7 |
(2)沉淀Ⅰ中的成分,除了Bi(OH)3沉淀外,还有 ____ 。
(3)A可以循环利用,A的化学式为 ____ 。在滤液1中,加入NaOH调节pH为8的目的是 ____ 。
(4)Cu3(AsO3)2沉淀加入一定量的水调成浆料,通入SO2,该过程的化学反应方程式是 ____ 。
(5)按照一定的液固比,将水加入Cu3(AsO3)2沉淀中,调成浆料。当反应温度为25℃,SO2流量为16L/h,液固比、时间对砷、铜浸出率的影响如图2甲、乙所示。请选择最适宜的液固比、反应时间: ____ 、 ____ 。

(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图3所示。若反应中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mol e-,则物质a为 ____ (填化学式)。
题目解答
答案
解:(1)为了加快中和过程的速率,可以采取的措施有适当增加NaOH溶液的浓度或加热,
故答案为:适当增加NaOH溶液的浓度或加热;
(2)由表中数据可知,调节pH=6时,沉淀Ⅰ中的成分,除了Bi(OH)3沉淀外,还有Fe(OH)3,
故答案为:Fe(OH)3;
(3)A可以循环利用,A的化学式为CuSO4,在滤液1中,加入NaOH调节pH为8的目的是完全沉淀铜离子,回收利用铜,
故答案为:CuSO4;完全沉淀铜离子,回收利用铜;
(4)Cu3(AsO3)2沉淀加入一定量的水调成浆料,通入SO2,该过程的化学反应方程式是Cu3(AsO3)2+6H2O+3SO2═2H3AsO3+H2SO4+Cu3(SO3)2•2H2O,
故答案为:Cu3(AsO3)2+6H2O+3SO2═2H3AsO3+H2SO4+Cu3(SO3)2•2H2O;
(5)由图可知,选择最适宜的液固比、反应时间为4:1、60min,砷、铜浸出率差别大、易分离,
故答案为:4:1;60min;
(6)反应中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mol e-,As、S元素的化合价应升高,氧气中氧元素的化合价降低,设S在产物中的化合价为x,则1mol×4×(3-2)+1mol×4×(x+2)=28,解得x=+4,则a为SO2,
故答案为:SO2。
故答案为:适当增加NaOH溶液的浓度或加热;
(2)由表中数据可知,调节pH=6时,沉淀Ⅰ中的成分,除了Bi(OH)3沉淀外,还有Fe(OH)3,
故答案为:Fe(OH)3;
(3)A可以循环利用,A的化学式为CuSO4,在滤液1中,加入NaOH调节pH为8的目的是完全沉淀铜离子,回收利用铜,
故答案为:CuSO4;完全沉淀铜离子,回收利用铜;
(4)Cu3(AsO3)2沉淀加入一定量的水调成浆料,通入SO2,该过程的化学反应方程式是Cu3(AsO3)2+6H2O+3SO2═2H3AsO3+H2SO4+Cu3(SO3)2•2H2O,
故答案为:Cu3(AsO3)2+6H2O+3SO2═2H3AsO3+H2SO4+Cu3(SO3)2•2H2O;
(5)由图可知,选择最适宜的液固比、反应时间为4:1、60min,砷、铜浸出率差别大、易分离,
故答案为:4:1;60min;
(6)反应中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mol e-,As、S元素的化合价应升高,氧气中氧元素的化合价降低,设S在产物中的化合价为x,则1mol×4×(3-2)+1mol×4×(x+2)=28,解得x=+4,则a为SO2,
故答案为:SO2。