题目
ZnO是一种常用的化学添加剂,广泛应用于塑料、合成橡胶、药膏、食品、电池、阻燃剂等产品的制作中。利用锌精矿(主要成分为ZnS,杂质为CuS、FeS、SiO2)制备ZnO的一种工艺流程如图:足量空气 112SO4 足量NaOH 足量CO2-|||-锌精矿 一 焙烧 酸浸 过滤1 沉杂 一 过滤2 沉锌 过滤3 H 洗涤 灼烧 一 →ZnO-|||-烟气 滤渣1 滤渣2 滤液3已知:Zn(OH)2可与足量NaOH反应生成Na2[Zn(OH)4];Kb(NH3⋅H2O)=1.8×10-5。回答下列问题:(1)写出“焙烧”过程中ZnS发生反应的化学方程式: ____ ,产物中气体分子的空间结构为 ____ 。(2)写出“酸浸”时含铁化合物发生反应的离子方程式: ____ 。(3)“滤渣1”的成分是 ____ (填化学式,后同),“滤液3”的溶质是 ____ 。(4)“沉杂”时加入过量NaOH的目的是 ____ 。(5)Zn(OH)2亦可溶于氨水,发生如下两个反应:①Zn(OH)2+4NH3⋅H2O═Zn(NH3)42++2OH-+4H2O K1=1.2×10-7②Zn(OH)2+2NH3⋅H2O═Zn(OH)42-+2NH4+K2=5.9×10-9现向足量Zn(OH)2中加入氨水,通过调节控制溶解后溶液中c(NH3⋅H2O)=c(NH4+)=0.1mol⋅L-1,则溶解后溶液中c[Zn(NH3)42+]:c[Zn(OH)42-]= ____ (保留两位有效数字)。(6)“洗涤”后,将10.7g滤渣充分灼烧得到8.1gZnO,比预期产量 ____ (填“偏高”或“偏低”),可能的原因是 ____ 。
ZnO是一种常用的化学添加剂,广泛应用于塑料、合成橡胶、药膏、食品、电池、阻燃剂等产品的制作中。利用锌精矿(主要成分为ZnS,杂质为CuS、FeS、SiO2)制备ZnO的一种工艺流程如图:
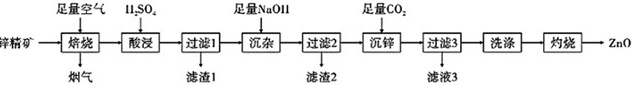
已知:Zn(OH)2可与足量NaOH反应生成Na2[Zn(OH)4];Kb(NH3⋅H2O)=1.8×10-5。
回答下列问题:
(1)写出“焙烧”过程中ZnS发生反应的化学方程式: ____ ,产物中气体分子的空间结构为 ____ 。
(2)写出“酸浸”时含铁化合物发生反应的离子方程式: ____ 。
(3)“滤渣1”的成分是 ____ (填化学式,后同),“滤液3”的溶质是 ____ 。
(4)“沉杂”时加入过量NaOH的目的是 ____ 。
(5)Zn(OH)2亦可溶于氨水,发生如下两个反应:
①Zn(OH)2+4NH3⋅H2O═Zn(NH3)42++2OH-+4H2O K1=1.2×10-7
②Zn(OH)2+2NH3⋅H2O═Zn(OH)42-+2NH4+K2=5.9×10-9
现向足量Zn(OH)2中加入氨水,通过调节控制溶解后溶液中c(NH3⋅H2O)=c(NH4+)=0.1mol⋅L-1,则溶解后溶液中c[Zn(NH3)42+]:c[Zn(OH)42-]= ____ (保留两位有效数字)。
(6)“洗涤”后,将10.7g滤渣充分灼烧得到8.1gZnO,比预期产量 ____ (填“偏高”或“偏低”),可能的原因是 ____ 。

已知:Zn(OH)2可与足量NaOH反应生成Na2[Zn(OH)4];Kb(NH3⋅H2O)=1.8×10-5。
回答下列问题:
(1)写出“焙烧”过程中ZnS发生反应的化学方程式: ____ ,产物中气体分子的空间结构为 ____ 。
(2)写出“酸浸”时含铁化合物发生反应的离子方程式: ____ 。
(3)“滤渣1”的成分是 ____ (填化学式,后同),“滤液3”的溶质是 ____ 。
(4)“沉杂”时加入过量NaOH的目的是 ____ 。
(5)Zn(OH)2亦可溶于氨水,发生如下两个反应:
①Zn(OH)2+4NH3⋅H2O═Zn(NH3)42++2OH-+4H2O K1=1.2×10-7
②Zn(OH)2+2NH3⋅H2O═Zn(OH)42-+2NH4+K2=5.9×10-9
现向足量Zn(OH)2中加入氨水,通过调节控制溶解后溶液中c(NH3⋅H2O)=c(NH4+)=0.1mol⋅L-1,则溶解后溶液中c[Zn(NH3)42+]:c[Zn(OH)42-]= ____ (保留两位有效数字)。
(6)“洗涤”后,将10.7g滤渣充分灼烧得到8.1gZnO,比预期产量 ____ (填“偏高”或“偏低”),可能的原因是 ____ 。
题目解答
答案
解:(1)“焙烧”过程中ZnS和O2发生氧化还原反应生成ZnO和SO2,发生反应的化学方程式:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2,产物中气体分子为SO2,SO2中S原子的价层电子对数=2+$\frac{6-2×2}{2}$=3且含有1个孤电子对,则SO2的空间结构为V形,
故答案为:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2;V形;
(2)“酸浸”时含铁化合物和氢离子反应生成Fe3+和H2O,发生反应的离子方程式:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(3)“滤渣1”的成分是SiO2,“滤液3”的溶质是NaHCO3和Na2SO4,
故答案为:SiO2;NaHCO3和Na2SO4;
(4)“沉杂”时加入过量NaOH的目的是除去Cu2+、Fe3+,
故答案为:除去Cu2+、Fe3+;
(5)通过调节控制溶解后溶液中c(NH3⋅H2O)=c(NH4+)=0.1mol⋅L-1,Kb(NH3⋅H2O)=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,c(OH-)=$\frac{{K}_{b}(N{H}_{3}•{H}_{2}O)•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$;K1=$\frac{c[Zn(N{H}_{3}{)_{4}}^{2+}]•{c}^{2}(O{H}^{-})}{{c}^{4}(N{H}_{3}•{H}_{2}O)}$,则c[Zn(NH3)42+]=$\frac{{K}_{1}•{c}^{4}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(O{H}^{-})}$;K2=$\frac{c[Zn(OH{)_{4}}^{2+}]•{c}^{2}(N{{H}_{4}}^{+})}{{c}^{2}(N{H}_{3}•{H}_{2}O)}$,c[Zn(OH)42-]=$\frac{{K}_{2}•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$,c[Zn(NH3)42+]:c[Zn(OH)42-]=$\frac{{K}_{1}•{c}^{4}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(O{H}^{-})}$:$\frac{{K}_{2}•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$=$\frac{{K}_{1}×(0.1)^{4}}{c(O{H}^{-})^{2}}$:K2=$\frac{{K}_{1}×(0.1)^{4}}{[\frac{{K}_{b}(N{H}_{3}•{H}_{2}O)×c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}]^{2}}$:K2=$\frac{{K}_{1}×(0.1)^{4}}{(\frac{1.8×1{0}^{-5}×0.1}{0.1})^{2}}$:K2=$\frac{1.2×1{0}^{-7}×(0.1)^{4}}{(1.8×1{0}^{-5})^{2}}$:5.9×10-9≈6.3×108,
故答案为:6.3×108;
(6)“洗涤”后,将10.7g滤渣充分灼烧得到8.1gZnO,如果滤渣完全是Zn(OH)2,灼烧后得到的m(ZnO)=$\frac{10.7g}{99g/mol}$×81g/mol≈8.75g>8.1g,所以比预期产量偏低,可能的原因是洗涤后没有干燥,
故答案为:偏低;洗涤后没有干燥。
故答案为:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2;V形;
(2)“酸浸”时含铁化合物和氢离子反应生成Fe3+和H2O,发生反应的离子方程式:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(3)“滤渣1”的成分是SiO2,“滤液3”的溶质是NaHCO3和Na2SO4,
故答案为:SiO2;NaHCO3和Na2SO4;
(4)“沉杂”时加入过量NaOH的目的是除去Cu2+、Fe3+,
故答案为:除去Cu2+、Fe3+;
(5)通过调节控制溶解后溶液中c(NH3⋅H2O)=c(NH4+)=0.1mol⋅L-1,Kb(NH3⋅H2O)=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,c(OH-)=$\frac{{K}_{b}(N{H}_{3}•{H}_{2}O)•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$;K1=$\frac{c[Zn(N{H}_{3}{)_{4}}^{2+}]•{c}^{2}(O{H}^{-})}{{c}^{4}(N{H}_{3}•{H}_{2}O)}$,则c[Zn(NH3)42+]=$\frac{{K}_{1}•{c}^{4}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(O{H}^{-})}$;K2=$\frac{c[Zn(OH{)_{4}}^{2+}]•{c}^{2}(N{{H}_{4}}^{+})}{{c}^{2}(N{H}_{3}•{H}_{2}O)}$,c[Zn(OH)42-]=$\frac{{K}_{2}•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$,c[Zn(NH3)42+]:c[Zn(OH)42-]=$\frac{{K}_{1}•{c}^{4}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(O{H}^{-})}$:$\frac{{K}_{2}•{c}^{2}(N{H}_{3}•{H}_{2}O)}{{c}^{2}(N{{H}_{4}}^{+})}$=$\frac{{K}_{1}×(0.1)^{4}}{c(O{H}^{-})^{2}}$:K2=$\frac{{K}_{1}×(0.1)^{4}}{[\frac{{K}_{b}(N{H}_{3}•{H}_{2}O)×c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}]^{2}}$:K2=$\frac{{K}_{1}×(0.1)^{4}}{(\frac{1.8×1{0}^{-5}×0.1}{0.1})^{2}}$:K2=$\frac{1.2×1{0}^{-7}×(0.1)^{4}}{(1.8×1{0}^{-5})^{2}}$:5.9×10-9≈6.3×108,
故答案为:6.3×108;
(6)“洗涤”后,将10.7g滤渣充分灼烧得到8.1gZnO,如果滤渣完全是Zn(OH)2,灼烧后得到的m(ZnO)=$\frac{10.7g}{99g/mol}$×81g/mol≈8.75g>8.1g,所以比预期产量偏低,可能的原因是洗涤后没有干燥,
故答案为:偏低;洗涤后没有干燥。