题目
13-15 Cr和Fe同时沉积就能进行不锈钢电镀。-|||-(1)若 ^2+ 的浓度为 cdot (kg)^-1, 则 ^2+ 的浓度为多少?假定两个电极都不考虑超电势。-|||-(2)若电解 (r)^2+ 浓度为 .5molcdot (kg)^-1 ^2+ 浓度为 .5molcdot (kg)^-1 的混合液,假定Cr没有超电势,计-|||-算Fe析出的超电势。已知:-|||-(varphi )^theta ((Cr)^2+/Cr)=-0.56V, (varphi )^theta ((Fe)^2+/Fe)=-0.44(V)_(0)

题目解答
答案
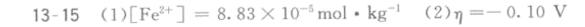
解析
本题主要考查能斯特方程在电镀过程中的应用,解题的关键在于根据两种金属同时沉积时电极电势相等这一条件,结合能斯特方程来计算离子浓度或超电势。
(1)计算$Fe^{2 + }$的浓度
当$Cr$和$Fe$同时沉积时,它们的电极电势相等,即$\varphi(Cr^{2 + }/Cr)=\varphi(Fe^{2 + }/Fe)$。
根据能斯特方程,对于电极反应$M^{n + } + ne^- \rightleftharpoons M$,其电极电势$\varphi$的表达式为$\varphi = \varphi^{\theta} + \frac{RT}{nF}\ln a_{M^{n + }}$,在稀溶液中,活度$a$近似等于浓度$c$。
- 计算$\varphi(Cr^{2 + }/Cr)$:
已知$\varphi^{\theta}(Cr^{2 + }/Cr)= - 0.56V$,$n = 2$,$c(Cr^{2 + })=1mol\cdot kg^{-1}$,$T = 298K$,$R = 8.314J\cdot mol^{-1}\cdot K^{-1}$,$F = 96485C\cdot mol^{-1}$,代入能斯特方程可得:
$\varphi(Cr^{2 + }/Cr)=\varphi^{\theta}(Cr^{2 + }/Cr) + \frac{RT}{2F}\ln c(Cr^{2 + })$
$=-0.56V + \frac{8.314J\cdot mol^{-1}\cdot K^{-1} \times 298K}{2\times 96485C\cdot mol^{-1}}\ln 1$
因为$\ln 1 = 0$,所以$\varphi(Cr^{2 + }/Cr)= - 0.56V$。 - 计算$c(Fe^{2 + })$:
由于$\varphi(Cr^{2 + }/Cr)=\varphi(Fe^{2 + }/Fe)$,$\varphi^{\theta}(Fe^{2 + }/Fe)= - 0.44V$,$n = 2$,则有:
$-0.56V = - 0.44V + \frac{8.314J\cdot mol^{-1}\cdot K^{-1} \times 298K}{2\times 96485C\cdot mol^{-1}}\ln c(Fe^{2 + })$
移项可得:
$\frac{8.314J\cdot mol^{-1}\cdot K^{-1} \times 298K}{2\times 96485C\cdot mol^{-1}}\ln c(Fe^{2 + })= - 0.56V + 0.44V = - 0.12V$
$\ln c(Fe^{2 + }) = \frac{- 0.12V\times 2\times 96485C\cdot mol^{-1}}{8.314J\cdot mol^{-1}\cdot K^{-1} \times 298K}\approx - 9.32$
$c(Fe^{2 + })=e^{- 9.32}\approx 8.83\times 10^{-5}mol\cdot kg^{-1}$
(2)计算$Fe$析出的超电势
同样根据$Cr$和$Fe$同时沉积时电极电势相等,即$\varphi(Cr^{2 + }/Cr)=\varphi(Fe^{2 + }/Fe)$,此时$\varphi(Fe^{2 + }/Fe)=\varphi^{\theta}(Fe^{2 + }/Fe) + \frac{RT}{2F}\ln c(Fe^{2 + }) + \eta$($\eta$为$Fe$析出的超电势)。
- 计算$\varphi(Cr^{2 + }/Cr)$:
已知$c(Cr^{2 + })=2.5mol\cdot kg^{-1}$,代入能斯特方程可得:
$\varphi(Cr^{2 + }/Cr)=\varphi^{\theta}(Cr^{2 + }/Cr) + \frac{RT}{2F}\ln c(Cr^{2 + })$
$=-0.56V + \frac{8.314J\cdot mol^{-1}\cdot K^{-1} \times 298K}{2\times 96485C\cdot mol^{-1}}\ln 2.5$
$\approx - 0.56V + 0.0089V = - 0.5511V$ - 计算$\eta$:
已知$c(Fe^{2 + })=0.5mol\cdot kg^{-1}$,则:
$\varphi(Fe^{2 + }/Fe)=\varphi^{\theta}(Fe^{2 + }/Fe) + \frac{RT}{2F}\ln c(Fe^{2 + }) + \eta$
$=-0.44V + \frac{8.314J\cdot mol^{-1}\cdot K^{-1} \times 298K}{2\times 96485C\cdot mol^{-1}}\ln 0.5 + \eta$
$\approx - 0.44V - 0.0044V + \eta = - 0.4444V + \eta$
因为$\varphi(Cr^{2 + }/Cr)=\varphi(Fe^{2 + }/Fe)$,所以:
$- 0.5511V = - 0.4444V + \eta$
$\eta = - 0.5511V + 0.4444V = - 0.1067V\approx - 0.10V$