(10分,每空1分)(1)______,______________,______________________________________________________________________________________________________________________________________________;________________(2)______________,________________(3)________2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。4.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项正确)1.下列物质中,属于强电解质的是A.氨水B.硫酸C.乙酸D.葡萄糖2.下列有关说法中正确的是A.铁与Cl2、盐酸均能发生反应生成FeCl3B.加热蒸干并灼烧铁、铝的氯化物溶液,最后均得到金属氧化物C.等物质的量的Na、Cu、Al与足量氯气反应时消耗氯气一样多D.常温下铁片、铝片与浓硫酸不能发生化学反应3.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)N2(g)+2CO2(g),下列说法中正确的是A.使用适当的催化剂不改变反应速率B.降低压强能提高反应速率C.升高温度能提高反应速率D.改变压强对反应速率无影响4.同温时,pH相等的盐酸溶液和醋酸溶液都稀释相同的倍数后,pH的大小关系是A.盐酸>醋酸B.醋酸>盐酸C.盐酸=醋D.无法判断5.物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是A.HX、HY、HZ B.HX、HZ、HY C.HZ、HY、HX D.HY、HZ、HX6.体积均为1 L的下列溶液中,阴离子个数最多的是A.0.1mol·L—1NaCl B. 0.1mol·L—1NH4NO3C.0.1mol·L—1NaOH D. 0.1mol·L—1Na2CO37.在平衡体系Ca(OH)2(s)Ca2++2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是A.加入少量MgCl2固体B.加入少量Na2CO3固体C.加入少量KCl固体D.加入少量稀H2SO48.下列说法中正确的是A.化学反应放热是因为反应物的总能量低于生成物的总能量B.不需要加热就能发生的反应是放热反应C.化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能D.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化9.下列有关说法,正确的是A.SO2的水溶液能导电,说明SO2是电解质B.Al(OH)3有弱碱性,可用于中和胃酸C.铜的金属性比铝弱,可以用铜罐贮运浓硝酸D.明矾和漂白粉常用于自来水的净化和消毒,两者原理相同10.下列离子方程式中,不正确的是A.向FeCl2溶液中通入Cl22Fe2++ Cl2=2Fe3++ 2ClˉB.FeCl3溶液跟过量氨水Fe3++ 3NH3•H2O=Fe(OH)3↓+ 3NH4+C.碳酸氢钙溶液跟稀硝酸Ca(HCO3)2+ 2H+=Ca2++ 2H2O + 2CO2↑D.钠与水的反应2Na + 2H2O = 2Na++ 2OH-+ H2↑11.一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g)2Z(g)一定达到化学平衡状态的是①容器中气体的密度不再发生变化②X、Y、Z的浓度不再发生变化③容器中的压强不再发生变化④单位时间内生成2n mol Z,同时消耗2n mol YA.①②B.②③C.③④D.①④12.一定量的的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入A.NaOH固体B.Na2SO4固体C.NH4Cl饱和溶液D.CH3COONa固体13.下列体系中,离子能大量共存的是A.无色透明的酸性溶液:MnO4-、K+、C1-、SO42-B.使酚酞变红的溶液:K+、Na+、NO3-、Cl-C.滴加KSCN显红色的溶液:NH4+、K+、Cl-、I-D.0.1 mol·L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH-14.下列装置、试剂选用或操作正确的是A.除去NO中的NO2B.铁制品表面镀锌C.稀释浓硫酸D.制备少量O215.在2A+B3C+5D中,下列表示该反应的速率最快的是A、v(A)=0.5 mol·(L·s)-1B、v(B)=0.3 mol·(L·s)-1C、v(C)=0.6 mol·(L·s)-1D、v(D)=0.8 mol·(L·s)-116. Na2S2O3溶液跟稀H2SO4反应的化学方程式为:。下列各组实验中,溶液中最先变浑浊的是17.反应2SO2+O22SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1¡¤s-1,则这段时间为()A、0.1 sB、2.5 sC、5 sD、10 s18.一定条件下的密闭容器中,可逆反应2A(g)B(g)+3C(g)在下列四种状态中处于平衡状态的是()19.关于温度对化学反应速率的影响,下列叙述正确的是()A、通常,温度升高,反应速率常数增大,化学反应速率提高B、化学反应的活化能越大,温度对化学反应速率的影响越小C、温度升高,降低化学反应的活化能,化学反应速率提高D、升高相同温度,对不同化学反应的反应速率的影响程度是一样的20.可确认发生了化学平衡移动的是()A、化学反应速率发生了改变B、有气态物质参加的可逆反应达到平衡后,改变了压强C、由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变D、可逆反应达到平衡后,使用催化剂3、不定项选择题(本题包括5小题,每小题4分,共20分。每个题目最多有两个答案)21.下列叙述I和II均正确并有因果关系的是22.在体积可变的密闭容器中,反应mA(气)+nB(固)pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是()A、(m+n)必定小于pB、(m+n)必定大于pC、m必定小于pD、m必定大于p23.可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是A.使用催化剂,C的物质的量分数增加B.升高温度,平衡向正反应方向移动C.化学方程式的系数a<c+dD.根据图像无法确定改变温度后平衡移动方向24.下列各溶液中,微粒的物质的量浓度关系正确的是A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合: c(NH4+)>c(Cl-)> c(OH-)>c(H+)B. 0.1mol·L-1Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3)C. 0.1mol·L-1NH4Cl溶液:c(NH4+)=c( Cl-)D.向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)=c(CH3COO-)+c(OH-)
(10分,每空1分)(1) ______,________
______,________
 ______,________________________________________________________________________________________________________________________________________
______,________________________________________________________________________________________________________________________________________
 ______;________________
______;________________
(2) ________
________
 ______,________________
______,________________
(3)________
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
4.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项正确)
1.下列物质中,属于强电解质的是
A.氨水B.硫酸C.乙酸D.葡萄糖
2.下列有关说法中正确的是
A.铁与Cl2、盐酸均能发生反应生成FeCl3
B.加热蒸干并灼烧铁、铝的氯化物溶液,最后均得到金属氧化物
C.等物质的量的Na、Cu、Al与足量氯气反应时消耗氯气一样多
D.常温下铁片、铝片与浓硫酸不能发生化学反应
3.已知汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g),下列说法中正确的是
N2(g)+2CO2(g),下列说法中正确的是
A.使用适当的催化剂不改变反应速率B.降低压强能提高反应速率
C.升高温度能提高反应速率D.改变压强对反应速率无影响
4.同温时,pH相等的盐酸溶液和醋酸溶液都稀释相同的倍数后,pH的大小关系是
A.盐酸>醋酸B.醋酸>盐酸C.盐酸=醋D.无法判断
5.物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A.HX、HY、HZ B.HX、HZ、HY C.HZ、HY、HX D.HY、HZ、HX
6.体积均为1 L的下列溶液中,阴离子个数最多的是
A.0.1mol·L—1NaCl B. 0.1mol·L—1NH4NO3
C.0.1mol·L—1NaOH D. 0.1mol·L—1Na2CO3
7.在平衡体系Ca(OH)2(s) Ca2++2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2++2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
A.加入少量MgCl2固体B.加入少量Na2CO3固体
C.加入少量KCl固体D.加入少量稀H2SO4
8.下列说法中正确的是
A.化学反应放热是因为反应物的总能量低于生成物的总能量
B.不需要加热就能发生的反应是放热反应
C.化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能
D.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
9.下列有关说法,正确的是
A.SO2的水溶液能导电,说明SO2是电解质
B.Al(OH)3有弱碱性,可用于中和胃酸
C.铜的金属性比铝弱,可以用铜罐贮运浓硝酸
D.明矾和漂白粉常用于自来水的净化和消毒,两者原理相同
10.下列离子方程式中,不正确的是
A.向FeCl2溶液中通入Cl22Fe2++ Cl2=2Fe3++ 2Clˉ
B.FeCl3溶液跟过量氨水Fe3++ 3NH3•H2O=Fe(OH)3↓+ 3NH4+
C.碳酸氢钙溶液跟稀硝酸Ca(HCO3)2+ 2H+=Ca2++ 2H2O + 2CO2↑
D.钠与水的反应2Na + 2H2O = 2Na++ 2OH-+ H2↑
11.一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是①容器中气体的密度不再发生变化②X、Y、Z的浓度不再发生变化
2Z(g)一定达到化学平衡状态的是①容器中气体的密度不再发生变化②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化④单位时间内生成2n mol Z,同时消耗2n mol Y
A.①②B.②③C.③④D.①④
12.一定量的的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入
A.NaOH固体B.Na2SO4固体C.NH4Cl饱和溶液D.CH3COONa固体
13.下列体系中,离子能大量共存的是
A.无色透明的酸性溶液:MnO4-、K+、C1-、SO42-
B.使酚酞变红的溶液:K+、Na+、NO3-、Cl-
C.滴加KSCN显红色的溶液:NH4+、K+、Cl-、I-
D.0.1 mol·L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH-
14.下列装置、试剂选用或操作正确的是
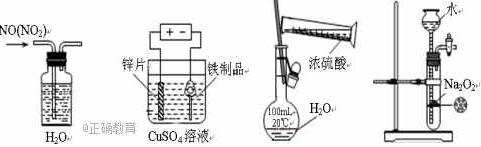
A.除去NO中的NO2B.铁制品表面镀锌C.稀释浓硫酸D.制备少量O2
15.在2A+B 3C+5D中,下列表示该反应的速率最快的是
3C+5D中,下列表示该反应的速率最快的是
A、v(A)=0.5 mol·(L·s)-1B、v(B)=0.3 mol·(L·s)-1
C、v(C)=0.6 mol·(L·s)-1D、v(D)=0.8 mol·(L·s)-1
16. Na2S2O3溶液跟稀H2SO4反应的化学方程式为: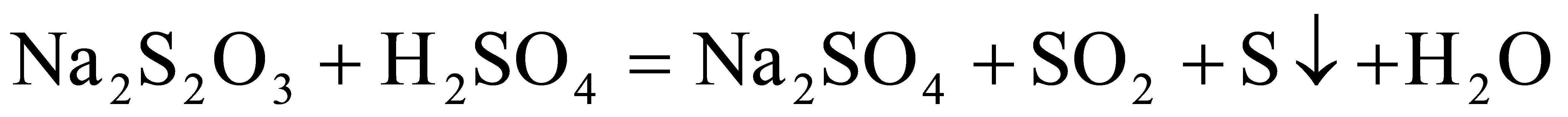 。下列各组实验中,溶液中最先变浑浊的是
。下列各组实验中,溶液中最先变浑浊的是
17.反应2SO2+O22SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1¡¤s-1,则这段时间为()
A、0.1 sB、2.5 sC、5 sD、10 s
18.一定条件下的密闭容器中,可逆反应2A(g)B(g)+3C(g)在下列四种状态中处于平衡状态的是()
19.关于温度对化学反应速率的影响,下列叙述正确的是()
A、通常,温度升高,反应速率常数增大,化学反应速率提高
B、化学反应的活化能越大,温度对化学反应速率的影响越小
C、温度升高,降低化学反应的活化能,化学反应速率提高
D、升高相同温度,对不同化学反应的反应速率的影响程度是一样的
20.可确认发生了化学平衡移动的是()
A、化学反应速率发生了改变B、有气态物质参加的可逆反应达到平衡后,改变了压强
C、由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D、可逆反应达到平衡后,使用催化剂
3、不定项选择题(本题包括5小题,每小题4分,共20分。每个题目最多有两个答案)
21.下列叙述I和II均正确并有因果关系的是
22.在体积可变的密闭容器中,反应mA(气)+nB(固)pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是()
A、(m+n)必定小于pB、(m+n)必定大于pC、m必定小于pD、m必定大于p
23.可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是

A.使用催化剂,C的物质的量分数增加B.升高温度,平衡向正反应方向移动
C.化学方程式的系数a<c+dD.根据图像无法确定改变温度后平衡移动方向
24.下列各溶液中,微粒的物质的量浓度关系正确的是
A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合: c(NH4+)>c(Cl-)> c(OH-)>c(H+)
B. 0.1mol·L-1Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3)
C. 0.1mol·L-1NH4Cl溶液:c(NH4+)=c( Cl-)
D.向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)=c(CH3COO-)+c(OH-)
题目解答
答案
10 N>C>O 6 1s22s22p63s23p63d6或【Ar】3d6 高 HCOOH分子间能形成氢键 de ; 正四面体 sp2 3