题目
预配制pH=4.00浓度为1.0mol.L-1的缓冲溶液1.0L,HAc和NaAc各需多少克?已知Ka=1.8x10-5,pka=4.74。
预配制pH=4.00浓度为1.0mol.L-1的缓冲溶液1.0L,HAc和NaAc各需多少克?
已知Ka=1.8x10-5,pka=4.74。
题目解答
答案
解: C(HAc)+C(NaAc)=1.0mol/L, 则C(HAc)= 1.0mol/L- C(NaAc)
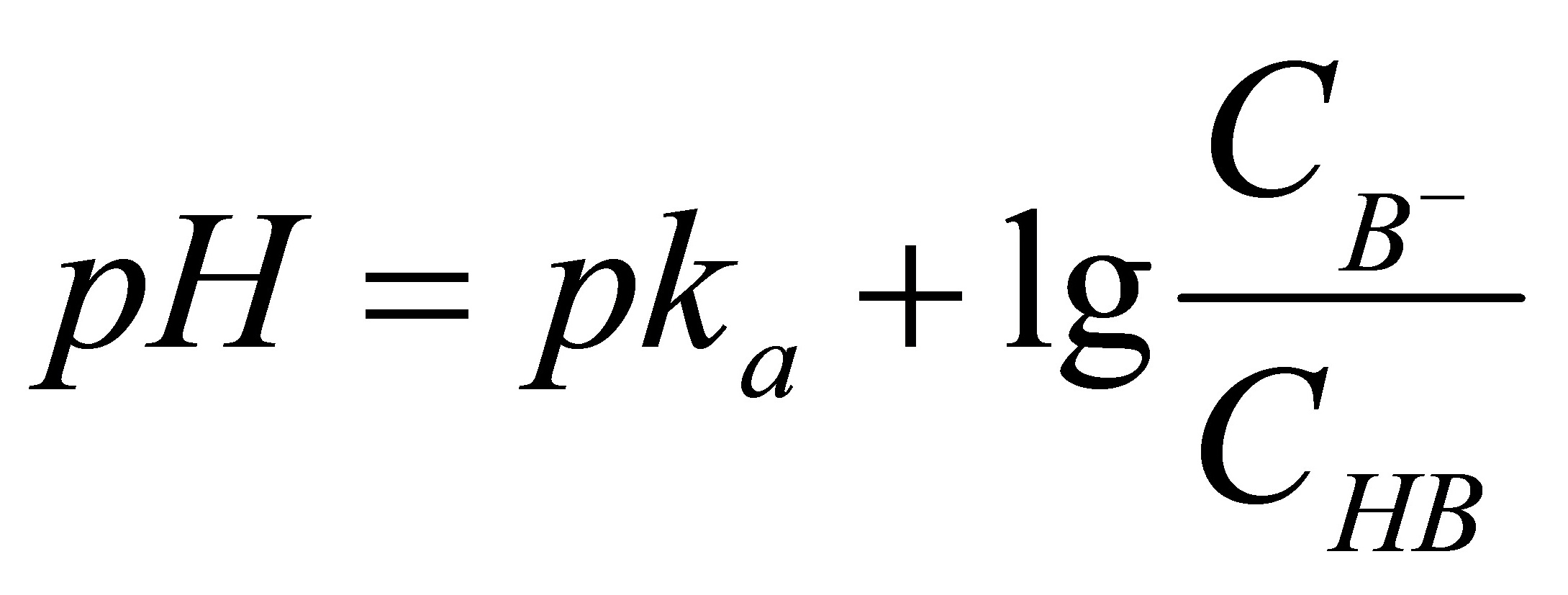 PH=4 根据
PH=4 根据
4=4.74+lg C(NaAc) /1.0mol/L- C(NaAc)
C(NaAc) =0.15 mol/L,
所以需HAc的质量:m=(1-0.15) mol/L×60g/ mol×1L=51 g
需NaAc的质量:m=0.15mol/L×82.034g/ mol×1L=12 g
解析
步骤 1:确定缓冲溶液的组成
缓冲溶液由HAc(乙酸)和NaAc(乙酸钠)组成,它们的总浓度为1.0 mol/L。设HAc的浓度为C(HAc),NaAc的浓度为C(NaAc)。根据题目,C(HAc) + C(NaAc) = 1.0 mol/L。
步骤 2:应用缓冲溶液的pH计算公式
缓冲溶液的pH值可以通过公式pH = pKa + log(C(NaAc)/C(HAc))来计算。已知pH = 4.00,pKa = 4.74,代入公式得到:
4.00 = 4.74 + log(C(NaAc)/C(HAc))。
步骤 3:求解C(NaAc)和C(HAc)
从步骤2的公式中解出C(NaAc)/C(HAc)的值,得到:
log(C(NaAc)/C(HAc)) = 4.00 - 4.74 = -0.74。
C(NaAc)/C(HAc) = 10^(-0.74) ≈ 0.182。
由于C(HAc) + C(NaAc) = 1.0 mol/L,可以解出C(NaAc)和C(HAc)的值:
C(NaAc) = 0.182 * C(HAc)。
C(HAc) + 0.182 * C(HAc) = 1.0 mol/L。
C(HAc) = 1.0 mol/L / (1 + 0.182) ≈ 0.85 mol/L。
C(NaAc) = 1.0 mol/L - C(HAc) ≈ 0.15 mol/L。
步骤 4:计算所需HAc和NaAc的质量
HAc的摩尔质量为60 g/mol,NaAc的摩尔质量为82.03 g/mol。根据步骤3中得到的浓度,计算所需的质量:
m(HAc) = C(HAc) * 摩尔质量 * 体积 = 0.85 mol/L * 60 g/mol * 1 L = 51 g。
m(NaAc) = C(NaAc) * 摩尔质量 * 体积 = 0.15 mol/L * 82.03 g/mol * 1 L = 12 g。
缓冲溶液由HAc(乙酸)和NaAc(乙酸钠)组成,它们的总浓度为1.0 mol/L。设HAc的浓度为C(HAc),NaAc的浓度为C(NaAc)。根据题目,C(HAc) + C(NaAc) = 1.0 mol/L。
步骤 2:应用缓冲溶液的pH计算公式
缓冲溶液的pH值可以通过公式pH = pKa + log(C(NaAc)/C(HAc))来计算。已知pH = 4.00,pKa = 4.74,代入公式得到:
4.00 = 4.74 + log(C(NaAc)/C(HAc))。
步骤 3:求解C(NaAc)和C(HAc)
从步骤2的公式中解出C(NaAc)/C(HAc)的值,得到:
log(C(NaAc)/C(HAc)) = 4.00 - 4.74 = -0.74。
C(NaAc)/C(HAc) = 10^(-0.74) ≈ 0.182。
由于C(HAc) + C(NaAc) = 1.0 mol/L,可以解出C(NaAc)和C(HAc)的值:
C(NaAc) = 0.182 * C(HAc)。
C(HAc) + 0.182 * C(HAc) = 1.0 mol/L。
C(HAc) = 1.0 mol/L / (1 + 0.182) ≈ 0.85 mol/L。
C(NaAc) = 1.0 mol/L - C(HAc) ≈ 0.15 mol/L。
步骤 4:计算所需HAc和NaAc的质量
HAc的摩尔质量为60 g/mol,NaAc的摩尔质量为82.03 g/mol。根据步骤3中得到的浓度,计算所需的质量:
m(HAc) = C(HAc) * 摩尔质量 * 体积 = 0.85 mol/L * 60 g/mol * 1 L = 51 g。
m(NaAc) = C(NaAc) * 摩尔质量 * 体积 = 0.15 mol/L * 82.03 g/mol * 1 L = 12 g。