实验探究:碳酸钠与碳酸氢钠是实验室常用的两种样品,某班七个化学学习小组进行了一系列实验。(1)第1小组探究碳酸根的沉淀有关问题(流程图如下):水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液已知:① 难溶物质的沉淀溶解平衡存在溶度积常数Ksp,其表达式和所有规则都和平衡常数类似。② 银离子与溴离子可以生成一种稳定的可溶性络合离子(二硫代硫酸根合银(I)酸根)。35. 本实验所配置的碳酸钠溶液为100mL,取出10mL进行实验,且加入的是20mL 0.1mol/L AgNO3溶液。从药品的利用率考虑,下列称取碳酸钠的质量最合理的是 。a. 106gb. 10.6gc. 1.06gd. 0.106g36. 试剂a中一定含有的阴离子是 。试剂a可能的最少微粒种数是 种。37. 试从平衡移动的角度解释步骤V中反应发生的原因。 。38. 在碳酸钠饱和溶液中加入硫酸钡固体会析出碳酸钡沉淀,能否据此判断碳酸钡的溶度积常数小于硫酸钡的溶度积常数? (选填“可以”或“不可以”) 。(2)第2小组探究碳酸根对于不同金属离子沉淀的影响。39. 小组成员测得碳酸钙在pH=6.5时完全沉淀,而相同温度、浓度下,氢氧化钙沉淀pH为11.9。据此,该成员判断同浓度碳酸钠的碱性比氢氧化钠强。试从理论和实验两方面分析该同学的错误原因。 针对某市售铁屑(含少量锡、氧化铁等杂质),同学们用如下方案制得纯净绿矾:水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液已知:室温下饱和碳酸溶液pH约为3.7,SnCO3沉淀完全时溶液的pH为2.6,FeCO3开始沉淀时溶液的pH为6.2,完全沉淀时溶液pH为8.4。40. 溶解过程中需要对溶液加热,当看到 (填写现象)时应停止加热,并趁热进行操作II( ),其目的是 。41. (1)操作III中,通二氧化碳至饱和的目的是 ,加入少量铁屑和稀硫酸并调节pH=3.0的目的是 。滤渣c的成分是 (填化学式)。(2)操作V的顺序依次为 、 、 。(3)操作V得到的绿矾晶体用少量冰水洗涤。洗涤需要的玻璃仪器有 ;用冰水洗涤的目的是:① ;② 。(4)结晶得到绿矾后的溶液中所含溶质有 (填化学式),能否直接排放? 。42. 该小组所制的绿矾不慎洒落到地上,混入了不溶性杂质,现要测定其中绿矾的纯度。① 任写一个用氧化还原滴定法测定绿矾纯度的反应的离子方程式: 。② 该小组用重量法测定,称取不纯样品m1g,经恒重操作后最后得到固体m2g。根据所给信息,能否求出绿矾纯度?若可以,则写出唯一表达式;若不能,简述理由。。(3)第3小组定性检某可能含验碳酸钠与碳酸氢钠中一种或两种的固体中的阴离子(流程图如下):水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液43. 试剂d可以是 ,试剂f可以是 。a. BaCl2溶液b. NaOH溶液c. MgCl2溶液d. Ba(OH)2溶液指导老师认为该小组的检验过程仍然不够严密,请给出改进措施。 。44. 判断II和IV中是否沉淀完全的方法是 。对滤渣e进行洗涤,如何判断沉淀已洗净? 。45. 小组成员又提出另一种定性检验的方案,以下是其实验过程:(利用碳酸氢钠分解这一性质)① 查阅资料,得知室温下0.1mol/L碳酸氢钠溶液pH为8.4,0.05mol/L碳酸钠溶液pH为11.5。② 将一定质量的固体样品溶于水后冷却至室温,用 测得其pH=8.4。③ 将上述溶液加热煮沸后冷却至室温,测得其pH=11.5。④ 作出结论:固体样品中只有碳酸氢钠,不含碳酸钠。指导他们的江老师严厉地批评该小组犯了学品问题,责令其抄写《电解质溶液》、《钠及其化合物》、《物质的检验与鉴别》讲稿,江老师批评他们的理由可能是 。a. 设计上,物质鉴别要求简单易行,该小组新实验方案比起原方案操作繁琐复杂不易行b. 室温下,X溶液是0.1mol/L碳酸氢钠溶液不是X溶液pH=8.4的充要条件c. 煮沸时,可能原有碳酸钠发生水解,生成碳酸氢钠,使pH降低d. 煮沸时,水蒸发导致体积减小,生成碳酸钠的物质的量浓度大于原碳酸氢钠浓度的两倍e. 煮沸时,碳酸氢钠可能未完全分解生成碳酸钠,二氧化碳可能未完全逸出(4)第4、5、6小组定量检验碳酸钠与碳酸氢钠混合物(不含其它杂质)中各成分的含量。① 第4小组采用重量法进行测定,他们设计了如下两种方案:水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液46. 方案一:(1)装置I中是 (填试剂名称),作用是 。装置V中是 (填试剂名称),作用是 。缺少I、V将分别使所测得碳酸钠的质量分数 、 (选填“偏大”、“偏小”或“无影响”)(2)实验步骤:(注:仪器已连接好,圆括号中填选项,长横线上填操作)①【查】检查装置II、III装置的气密性:( ), ;②【装】向各装置中加入所需药品。装置III的作用是 ;③【通】( ), ,该操作的目的是 ;④【滴】( ), ,分液漏斗中的稀硫酸必须足量;⑤【▲】( ), ,该操作的目的是 。a. 关闭a、c、d,打开b b. 关闭a、b、d,打开c c. 关闭b、d,打开a、cd. 关闭b、c,打开a、d e. 关闭a、b,打开c、d f. 关闭a、c,打开b、d(3)实验称取固体3.580g,测得装置IV增重1.760g,则碳酸钠的物质的量分数为 。47. 方案二:第②步中,判断HCO3-、CO32-是否沉淀完全的方法是 。判断固体恒重的方法是 。写出碳酸钠质量分数的表达式:w(Na2CO3)= 。48. 从简易可行、精确度角度来看,方案 (选填“一”或“二”)更优,简述原因。。② 第5小组采用气体法进行测定,他们设计了如下装置:(B管中在液面上覆盖一层苯,装置气密性良好)水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液49. 已知二氧化碳不溶于四氯化碳,能否用四氯化碳代替苯? 。50. 如果要用过量样品测定硫酸浓度,应将 倒入(或放入)中,简述原因。 。51. 在反应结束后要读出气体体积时,要注意哪些问题?(至少回答3条)① ;② ;③ 。52. 该量气装置比《化学(上海科学技术出版社)高二年级第一学期》在《测定1mol气体体积》中所用的实验装置(由 、、 组成)的精确度更高,简述原因。。③ 第6小组采用连续滴定法测定混合物中碳酸氢钠的质量分数。53. 请画出实验流程图,并写出计算碳酸氢钠的质量分数的计算式(不必化简,说明其中各字母的含义)。水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液54. 简述滴定管在滴定前必须进行的操作、你选用如上指示剂的原因及滴定终点的现象。。55. 如果在10g样品中含有1g亚硫酸氢钠,则其测定的绝对误差是 (保留3位有效数字)。人体血液中存在的平衡:H2CO3水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液 HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。已知pH随水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液变化关系如表所示,则下列说法中错误的是 。水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液a. 在pH=7的血液中,c(HCO3-)>c(H2CO3)b. 正常体温下人体发生碱中毒时,c(H+)•c(OH-)变大c. 人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒d.水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液=20.0时,H2CO3的电离程度小于HCO3-的水解程度(5)第7小组探究标注有“石碱、碳酸氢钠混合物”的固体样品与氢氧化钠、盐酸的反应,并通过酸碱滴定测出如下有关两组反应所消耗的反应物的数据:(与盐酸反应所用指示剂为甲基橙)水 硝酸银溶液 滤液 试剂a 硫代硫酸钠溶液-|||-碳酸钠 I溶解 Ⅱ沉淀 Ⅲ过滤 IV 一 →淡黄色沉淀 square 澄清-|||-固体 溶液56. 已知所有药品不含杂质,样品成分固定,且仪器精密度、准确度均无误。试通过计算和分析得出结论。
实验探究:碳酸钠与碳酸氢钠是实验室常用的两种样品,某班七个化学学习小组进行了一系列实验。
(1)第1小组探究碳酸根的沉淀有关问题(流程图如下):
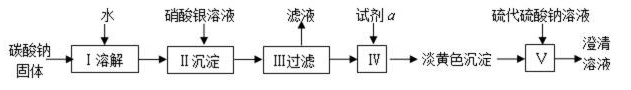
已知:① 难溶物质的沉淀溶解平衡存在溶度积常数Ksp,其表达式和所有规则都和平衡常数类似。
② 银离子与溴离子可以生成一种稳定的可溶性络合离子(二硫代硫酸根合银(I)酸根)。
35. 本实验所配置的碳酸钠溶液为100mL,取出10mL进行实验,且加入的是20mL 0.1mol/L AgNO3溶液。从药品的利用率考虑,下列称取碳酸钠的质量最合理的是 。
a. 106g
b. 10.6g
c. 1.06g
d. 0.106g
36. 试剂a中一定含有的阴离子是 。试剂a可能的最少微粒种数是 种。
37. 试从平衡移动的角度解释步骤V中反应发生的原因。
。
38. 在碳酸钠饱和溶液中加入硫酸钡固体会析出碳酸钡沉淀,能否据此判断碳酸钡的溶度积常数小于硫酸钡的溶度积常数? (选填“可以”或“不可以”) 。
(2)第2小组探究碳酸根对于不同金属离子沉淀的影响。
39. 小组成员测得碳酸钙在pH=6.5时完全沉淀,而相同温度、浓度下,氢氧化钙沉淀pH为11.9。据此,该成员判断同浓度碳酸钠的碱性比氢氧化钠强。试从理论和实验两方面分析该同学的错误原因。
针对某市售铁屑(含少量锡、氧化铁等杂质),同学们用如下方案制得纯净绿矾:
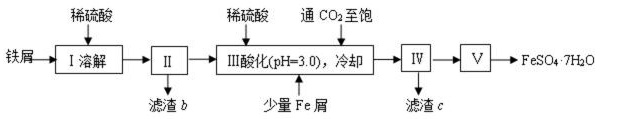
已知:室温下饱和碳酸溶液pH约为3.7,SnCO3沉淀完全时溶液的pH为2.6,
FeCO3开始沉淀时溶液的pH为6.2,完全沉淀时溶液pH为8.4。
40. 溶解过程中需要对溶液加热,当看到 (填写现象)时应停止加热,并趁热进行操作II( ),其目的是 。
41. (1)操作III中,通二氧化碳至饱和的目的是 ,加入少量铁屑和稀硫酸并调节pH=3.0的目的是 。滤渣c的成分是 (填化学式)。
(2)操作V的顺序依次为 、 、 。
(3)操作V得到的绿矾晶体用少量冰水洗涤。洗涤需要的玻璃仪器有 ;
用冰水洗涤的目的是:① ;② 。
(4)结晶得到绿矾后的溶液中所含溶质有 (填化学式),能否直接排放? 。
42. 该小组所制的绿矾不慎洒落到地上,混入了不溶性杂质,现要测定其中绿矾的纯度。
① 任写一个用氧化还原滴定法测定绿矾纯度的反应的离子方程式: 。
② 该小组用重量法测定,称取不纯样品m1g,经恒重操作后最后得到固体m2g。根据所给信息,能否求出绿矾纯度?若可以,则写出唯一表达式;若不能,简述理由。
。
(3)第3小组定性检某可能含验碳酸钠与碳酸氢钠中一种或两种的固体中的阴离子(流程图如下):
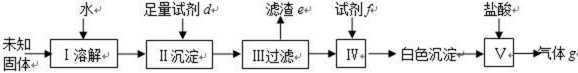
43. 试剂d可以是 ,试剂f可以是 。
a. BaCl2溶液
b. NaOH溶液
c. MgCl2溶液
d. Ba(OH)2溶液
指导老师认为该小组的检验过程仍然不够严密,请给出改进措施。
。
44. 判断II和IV中是否沉淀完全的方法是 。
对滤渣e进行洗涤,如何判断沉淀已洗净? 。
45. 小组成员又提出另一种定性检验的方案,以下是其实验过程:(利用碳酸氢钠分解这一性质)
① 查阅资料,得知室温下0.1mol/L碳酸氢钠溶液pH为8.4,0.05mol/L碳酸钠溶液pH为11.5。
② 将一定质量的固体样品溶于水后冷却至室温,用 测得其pH=8.4。
③ 将上述溶液加热煮沸后冷却至室温,测得其pH=11.5。
④ 作出结论:固体样品中只有碳酸氢钠,不含碳酸钠。
指导他们的江老师严厉地批评该小组犯了学品问题,责令其抄写《电解质溶液》、《钠及其化合物》、《物质的检验与鉴别》讲稿,江老师批评他们的理由可能是 。
a. 设计上,物质鉴别要求简单易行,该小组新实验方案比起原方案操作繁琐复杂不易行
b. 室温下,X溶液是0.1mol/L碳酸氢钠溶液不是X溶液pH=8.4的充要条件
c. 煮沸时,可能原有碳酸钠发生水解,生成碳酸氢钠,使pH降低
d. 煮沸时,水蒸发导致体积减小,生成碳酸钠的物质的量浓度大于原碳酸氢钠浓度的两倍
e. 煮沸时,碳酸氢钠可能未完全分解生成碳酸钠,二氧化碳可能未完全逸出
(4)第4、5、6小组定量检验碳酸钠与碳酸氢钠混合物(不含其它杂质)中各成分的含量。
① 第4小组采用重量法进行测定,他们设计了如下两种方案:
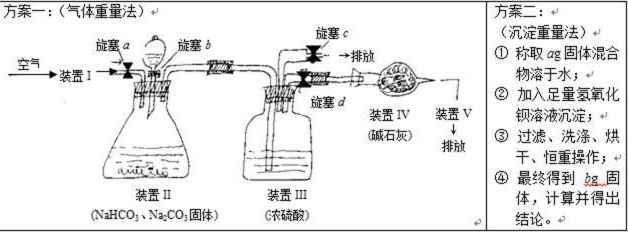
46. 方案一:(1)装置I中是 (填试剂名称),作用是 。
装置V中是 (填试剂名称),作用是 。缺少I、V将分别使所测得碳酸钠的质量分数 、 (选填“偏大”、“偏小”或“无影响”)
(2)实验步骤:(注:仪器已连接好,圆括号中填选项,长横线上填操作)
①【查】检查装置II、III装置的气密性:( ), ;
②【装】向各装置中加入所需药品。装置III的作用是 ;
③【通】( ), ,该操作的目的是 ;
④【滴】( ), ,分液漏斗中的稀硫酸必须足量;
⑤【▲】( ), ,该操作的目的是 。
a. 关闭a、c、d,打开b b. 关闭a、b、d,打开c c. 关闭b、d,打开a、c
d. 关闭b、c,打开a、d e. 关闭a、b,打开c、d f. 关闭a、c,打开b、d
(3)实验称取固体3.580g,测得装置IV增重1.760g,则碳酸钠的物质的量分数为 。
47. 方案二:第②步中,判断HCO3-、CO32-是否沉淀完全的方法是 。
判断固体恒重的方法是 。
写出碳酸钠质量分数的表达式:w(Na2CO3)= 。
48. 从简易可行、精确度角度来看,方案 (选填“一”或“二”)更优,简述原因。
。
② 第5小组采用气体法进行测定,他们设计了如下装置:(B管中在液面上覆盖一层苯,装置气密性良好)
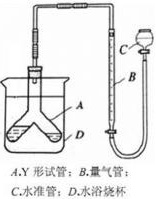
49. 已知二氧化碳不溶于四氯化碳,能否用四氯化碳代替苯? 。
50. 如果要用过量样品测定硫酸浓度,应将 倒入(或放入)
中,简述原因。 。
51. 在反应结束后要读出气体体积时,要注意哪些问题?(至少回答3条)
① ;② ;
③ 。
52. 该量气装置比《化学(上海科学技术出版社)高二年级第一学期》
在《测定1mol气体体积》中所用的实验装置(由 、
、 组成)的精确度更高,简述原因。
。
③ 第6小组采用连续滴定法测定混合物中碳酸氢钠的质量分数。
53. 请画出实验流程图,并写出计算碳酸氢钠的质量分数的计算式(不必化简,说明其中各字母的含义)。

54. 简述滴定管在滴定前必须进行的操作、你选用如上指示剂的原因及滴定终点的现象。
。
55. 如果在10g样品中含有1g亚硫酸氢钠,则其测定的绝对误差是 (保留3位有效数字)。
人体血液中存在的平衡:H2CO3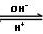 HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。已知pH随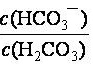 变化关系如表所示,则下列说法中错误的是 。
变化关系如表所示,则下列说法中错误的是 。
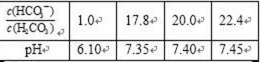
a. 在pH=7的血液中,c(HCO3-)>c(H2CO3)
b. 正常体温下人体发生碱中毒时,c(H+)•c(OH-)变大
c. 人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3
溶液解毒
d.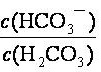 =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
(5)第7小组探究标注有“石碱、碳酸氢钠混合物”的固体样品与氢氧化钠、盐酸的反应,并通过酸碱滴定测出如下有关两组反应所消耗的反应物的数据:(与盐酸反应所用指示剂为甲基橙)
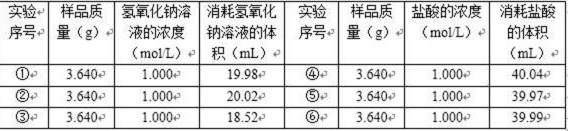
56. 已知所有药品不含杂质,样品成分固定,且仪器精密度、准确度均无误。试通过计算和分析得出结论。
题目解答
答案
见解析。