题目
5-2 甲烷CH4的初始状态为 _(1)=0.47MPa _(1)=393k, 经可逆定压冷却对-|||-外放出热量 .76 1mol, 试确定其终温及1 mol的C H4的热力学能变化-|||-量 Delta (U)_(m) 焓变化量 △Hm。 设甲烷的比热容近似为定值,且 _(p)=2.3298kJ/-|||-(kg·K)。

题目解答
答案
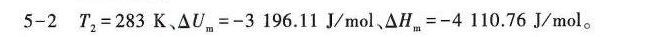
解析
步骤 1:确定甲烷的摩尔质量
甲烷(CH4)的摩尔质量为 $12 + 4 \times 1 = 16 g/mol$。
步骤 2:计算甲烷的比热容
已知 ${c}_{p}=2.3298kJ/(kg·K)$,将单位转换为 $J/(mol·K)$,即
${c}_{p} = 2.3298 \times 1000 \times 16 = 37276.8 J/(mol·K)$。
步骤 3:计算终温
根据定压过程的热量计算公式 $Q = n{c}_{p}\Delta T$,其中 $Q = -4110.76 J/mol$,$n = 1 mol$,${c}_{p} = 37276.8 J/(mol·K)$,代入公式得
$-4110.76 = 1 \times 37276.8 \times (T_{2} - 393)$,
解得 $T_{2} = 283 K$。
步骤 4:计算热力学能变化量 $\Delta {U}_{m}$
根据定压过程的热力学能变化量公式 $\Delta {U}_{m} = n{c}_{v}\Delta T$,其中 ${c}_{v} = {c}_{p} - R$,$R = 8.314 J/(mol·K)$,代入公式得
$\Delta {U}_{m} = 1 \times (37276.8 - 8.314) \times (283 - 393)$,
解得 $\Delta {U}_{m} = -3196.11 J/mol$。
步骤 5:计算焓变 $\Delta {H}_{m}$
根据定压过程的焓变公式 $\Delta {H}_{m} = n{c}_{p}\Delta T$,代入公式得
$\Delta {H}_{m} = 1 \times 37276.8 \times (283 - 393)$,
解得 $\Delta {H}_{m} = -4110.76 J/mol$。
甲烷(CH4)的摩尔质量为 $12 + 4 \times 1 = 16 g/mol$。
步骤 2:计算甲烷的比热容
已知 ${c}_{p}=2.3298kJ/(kg·K)$,将单位转换为 $J/(mol·K)$,即
${c}_{p} = 2.3298 \times 1000 \times 16 = 37276.8 J/(mol·K)$。
步骤 3:计算终温
根据定压过程的热量计算公式 $Q = n{c}_{p}\Delta T$,其中 $Q = -4110.76 J/mol$,$n = 1 mol$,${c}_{p} = 37276.8 J/(mol·K)$,代入公式得
$-4110.76 = 1 \times 37276.8 \times (T_{2} - 393)$,
解得 $T_{2} = 283 K$。
步骤 4:计算热力学能变化量 $\Delta {U}_{m}$
根据定压过程的热力学能变化量公式 $\Delta {U}_{m} = n{c}_{v}\Delta T$,其中 ${c}_{v} = {c}_{p} - R$,$R = 8.314 J/(mol·K)$,代入公式得
$\Delta {U}_{m} = 1 \times (37276.8 - 8.314) \times (283 - 393)$,
解得 $\Delta {U}_{m} = -3196.11 J/mol$。
步骤 5:计算焓变 $\Delta {H}_{m}$
根据定压过程的焓变公式 $\Delta {H}_{m} = n{c}_{p}\Delta T$,代入公式得
$\Delta {H}_{m} = 1 \times 37276.8 \times (283 - 393)$,
解得 $\Delta {H}_{m} = -4110.76 J/mol$。