(14分)(2013秋•和平区校级月考)化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验.①写出反应的化学方程式 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O ,氧化剂和还原剂的物质的量之比为 1:2 .②下列收集Cl2的正确装置是 C .③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 Cl2、HClO、ClO﹣ .④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置,发现溶液出现分层现象,下层溶液变为橙红色 .(2)工业制氯气是用电解饱和食盐水的方法.①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.其次除杂操作时,往粗盐水中先加入过量的 BaCl2 (填化学式),至沉淀不再产生后,再加入过量的 Na2CO3 和NaOH,充分反应后将沉淀一并滤去.②ClO2和Cl2均能将电镀废水中的CN﹣氧化为无毒的物质,自身被还原为Cl﹣.处理含CN﹣相同时的电镀废水,所需Cl2的物质的量是ClO2的 2.5 倍.考点:氯气的实验室制法.版权所有专题:卤族元素.分析:(1)①实验室用二氧化锰氧化浓盐酸来制备氯气反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;氧化剂为二氧化锰,还原剂为 HCl,依据电子守恒计算反应比;②依据氯气物理性质(氯气是一种密度大于空气,可溶于水的有毒气体)和装置特点解答;③氯气溶于水后大部分氯气仍然以氯气分子形式存在,少部分氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质部分电离,依据氯水的成分解答;④溴的四氯化碳显橙红色,氯气有强的氧化性能从溴化钠溶液中置换出溴,反应方程式:Cl2+2NaBr=Br2+2NaCl;(2)①盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;②每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.解答:解:(1)①实验室制备氯气反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,反应中氧化剂MnO2,还原剂HCl,依据元素化合价变化分析计算,二氧化锰中锰元素化合价+4价变化为+2价,电子转移2e﹣,还原剂反应的氯化氢为2mol,氧化剂和还原剂的物质的量之比为11:2;故答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;1:2;②A.只有进气口没有出气口,集气瓶内压强过大,易发生爆炸,故A错误;B.该装置收集的是密度小于空气的气体,而氯气密度大于空气,且氯气有毒不能直接排放,故B错误;C.该装置收集比空气密度大的气体氯气,剩余的氯气有毒需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,故C正确;D.氯气与氢氧化钠反应,得不到氯气,故D错误;故选C.③氯气和水反应的方程式:Cl2+H2O=HClO+HCl,氯水的成分:Cl2、HCl、H2O,H+、Cl﹣、ClO﹣、OH﹣,具有强氧化性的含氯元素的微粒为:Cl2、HClO、ClO﹣;故答案为:Cl2、HClO、ClO﹣;(4)氯气有强的氧化性能从溴化钠溶液中置换出溴,溴的四氯化碳溶液显橙红色,取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置.发现溶液出现分层现象,下层溶液变为橙红色,反应方程式:Cl2+2NaBr=Br2+2NaCl,故答案为:用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置,发现溶液出现分层现象,下层溶液变为橙红色;(2)①要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤就行了,最后加盐酸除去过量的氢氧根离子碳酸根离子,其次除杂操作时,往粗盐水中先加入过量的BaCl2,至沉淀不再产生后,再加入过量的Na2CO3,和NaOH溶液,充分反应后将沉淀一并滤去;故答案为:BaCl2;Na2CO3;②依据电子守恒分析计算,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5.点评:本题考查了氯气的实验室制法和氯水的成分和性质,氧化还原反应电子转移计算,题目难度不大,该部分内容是高考的热点,掌握基础是关键.
(14分)(2013秋•和平区校级月考)化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验.
①写出反应的化学方程式 MnO2+4HCl(浓)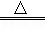 MnCl2+Cl2↑+2H2O ,氧化剂和还原剂的物质的量之比为 1:2 .
MnCl2+Cl2↑+2H2O ,氧化剂和还原剂的物质的量之比为 1:2 .
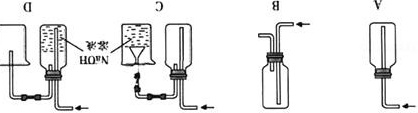
②下列收集Cl2的正确装置是 C .
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 Cl2、HClO、ClO﹣ .
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置,发现溶液出现分层现象,下层溶液变为橙红色 .
(2)工业制氯气是用电解饱和食盐水的方法.
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.其次除杂操作时,往粗盐水中先加入过量的 BaCl2 (填化学式),至沉淀不再产生后,再加入过量的 Na2CO3 和NaOH,充分反应后将沉淀一并滤去.
②ClO2和Cl2均能将电镀废水中的CN﹣氧化为无毒的物质,自身被还原为Cl﹣.处理含CN﹣相同时的电镀废水,所需Cl2的物质的量是ClO2的 2.5 倍.
考点:
氯气的实验室制法.版权所有
专题:
卤族元素.
分析:
(1)①实验室用二氧化锰氧化浓盐酸来制备氯气反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;氧化剂为二氧化锰,还原剂为 HCl,依据电子守恒计算反应比;
②依据氯气物理性质(氯气是一种密度大于空气,可溶于水的有毒气体)和装置特点解答;
③氯气溶于水后大部分氯气仍然以氯气分子形式存在,少部分氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质部分电离,依据氯水的成分解答;
④溴的四氯化碳显橙红色,氯气有强的氧化性能从溴化钠溶液中置换出溴,反应方程式:Cl2+2NaBr=Br2+2NaCl;
(2)①盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
②每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答:
解:(1)①实验室制备氯气反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,反应中氧化剂MnO2,还原剂HCl,依据元素化合价变化分析计算,二氧化锰中锰元素化合价+4价变化为+2价,电子转移2e﹣,还原剂反应的氯化氢为2mol,氧化剂和还原剂的物质的量之比为11:2;
故答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;1:2;
②A.只有进气口没有出气口,集气瓶内压强过大,易发生爆炸,故A错误;
B.该装置收集的是密度小于空气的气体,而氯气密度大于空气,且氯气有毒不能直接排放,故B错误;
C.该装置收集比空气密度大的气体氯气,剩余的氯气有毒需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,故C正确;
D.氯气与氢氧化钠反应,得不到氯气,故D错误;
故选C.
③氯气和水反应的方程式:Cl2+H2O=HClO+HCl,氯水的成分:Cl2、HCl、H2O,H+、Cl﹣、ClO﹣、OH﹣,具有强氧化性的含氯元素的微粒为:Cl2、HClO、ClO﹣;
故答案为:Cl2、HClO、ClO﹣;
(4)氯气有强的氧化性能从溴化钠溶液中置换出溴,溴的四氯化碳溶液显橙红色,取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置.发现溶液出现分层现象,下层溶液变为橙红色,反应方程式:Cl2+2NaBr=Br2+2NaCl,
故答案为:用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置,发现溶液出现分层现象,下层溶液变为橙红色;
(2)①要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤就行了,最后加盐酸除去过量的氢氧根离子碳酸根离子,其次除杂操作时,往粗盐水中先加入过量的BaCl2,至沉淀不再产生后,再加入过量的Na2CO3,和NaOH溶液,充分反应后将沉淀一并滤去;
故答案为:BaCl2;Na2CO3;
②依据电子守恒分析计算,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5.
点评:
本题考查了氯气的实验室制法和氯水的成分和性质,氧化还原反应电子转移计算,题目难度不大,该部分内容是高考的热点,掌握基础是关键.
题目解答
答案
分析:
(1)①实验室用二氧化锰氧化浓盐酸来制备氯气反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;氧化剂为二氧化锰,还原剂为 HCl,依据电子守恒计算反应比;
②依据氯气物理性质(氯气是一种密度大于空气,可溶于水的有毒气体)和装置特点解答;
③氯气溶于水后大部分氯气仍然以氯气分子形式存在,少部分氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质部分电离,依据氯水的成分解答;
④溴的四氯化碳显橙红色,氯气有强的氧化性能从溴化钠溶液中置换出溴,反应方程式:Cl2+2NaBr=Br2+2NaCl;
(2)①盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
②每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答:
解:(1)①实验室制备氯气反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,反应中氧化剂MnO2,还原剂HCl,依据元素化合价变化分析计算,二氧化锰中锰元素化合价+4价变化为+2价,电子转移2e﹣,还原剂反应的氯化氢为2mol,氧化剂和还原剂的物质的量之比为11:2;
故答案为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;1:2;
②A.只有进气口没有出气口,集气瓶内压强过大,易发生爆炸,故A错误;
B.该装置收集的是密度小于空气的气体,而氯气密度大于空气,且氯气有毒不能直接排放,故B错误;
C.该装置收集比空气密度大的气体氯气,剩余的氯气有毒需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,故C正确;
D.氯气与氢氧化钠反应,得不到氯气,故D错误;
故选C.
③氯气和水反应的方程式:Cl2+H2O=HClO+HCl,氯水的成分:Cl2、HCl、H2O,H+、Cl﹣、ClO﹣、OH﹣,具有强氧化性的含氯元素的微粒为:Cl2、HClO、ClO﹣;
故答案为:Cl2、HClO、ClO﹣;
(4)氯气有强的氧化性能从溴化钠溶液中置换出溴,溴的四氯化碳溶液显橙红色,取少量新制氯水和CCl4于试管中,用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置.发现溶液出现分层现象,下层溶液变为橙红色,反应方程式:Cl2+2NaBr=Br2+2NaCl,
故答案为:用胶头滴管向试管中滴加溴化钠溶液、振荡使其充分反应,静置,发现溶液出现分层现象,下层溶液变为橙红色;
(2)①要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤就行了,最后加盐酸除去过量的氢氧根离子碳酸根离子,其次除杂操作时,往粗盐水中先加入过量的BaCl2,至沉淀不再产生后,再加入过量的Na2CO3,和NaOH溶液,充分反应后将沉淀一并滤去;
故答案为:BaCl2;Na2CO3;
②依据电子守恒分析计算,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5.